#Tau Protein
Explore tagged Tumblr posts
Text
Semaglutide enhances cognitive abilities and reduces Alzheimer’s pathology in mice and human brain models
A study in *Biomedicine & Pharmacotherapy* explored the effects of Semaglutide on Alzheimer's Disease (AD) in mouse and human brain organoid models. Researchers found that Semaglutide improved cognitive function, reduced amyloid plaque and Tau protein levels, and decreased neuroinflammation in APP/PS1 mice. Behavioral tests indicated enhanced learning and memory, while biochemical assessments showed modulation of key neuroprotective pathways. Additionally, Semaglutide increased oxytocin levels in human models, suggesting its therapeutic potential through GLP-1 receptor and oxytocin interaction. These findings point to Semaglutide as a promising candidate in AD treatment, warranting further research.
#Semaglutide#Cognitive enhancement#Alzheimer's disease#APP/PS1 mice#Amyloid plaque reduction#Tau protein#Neuroinflammation#Learning and memory improvement#GLP-1 receptor#Oxytocin interaction#Brain organoid models#Neuroprotective pathways#Alzheimer's pathology#Therapeutic potential#Biomedicine & Pharmacotherapy
0 notes
Text
Can a light and sound show for the brain treat cognitive decline?
An article published by Nature recently caught my eye. Instead of medication, a non-invasive treatment called “gamma frequency stimulation” has shown some promise in curbing further cognitive decline in those in the early stages of Alzheimer’s disease, according to early clinical trial study results. The method may sound dubious at first but the science behind it is interesting. Researchers have…

View On WordPress
0 notes
Text
Cholesterol in brain network: how does its presence affects health or neurodegeneration?
Cholesterol in brain health and disease Cholesterol is found in the cell membranes of all human cells. It plays an integral role in neuronal signaling and synaptic connections, especially in the brain. Notably, the brain contains between 20-25% of all the body’s cholesterol reserves, making it the organ with the highest cholesterol concentration in the human body. Interestingly, peripheral…
#alpha-synuclein#Alzheimer#beta-amyloid#brain aging#cell membrane#cell receptors#cholesterol#growth factors#lipid rafts#neurodegeneration#neurofibrillary tangles#neuronal damage#neurotransmitters#Parkinson disease#signaling pathway#synaptic plasticity#tau protein
0 notes
Text

Recent Insights in Alzheimer Research |
Discover the latest insights into Alzheimers research, shedding light on advancements in diagnosis and treatment.
#Alzheimer's#dementia#x27;s disease#neurodegenerative disease#x27;s research insights#x27;s research#Neurological Biomarkers#Tau Protein#FDA-Approved Drugs#Nanotechnology#CME Programs#CME Conferences#CME Medical courses#CME credits#doctor conferences#medical CME#Primary Care Conference#Medical CME Online#Emergency Medicine Online CME#Medical Conference Website#Physician Conferences#Medical CME Courses#Doctors CME Conferences#CME training for Physicians#Medical Event Organizer#Organizing Medical Events#Medical Conferences#Medical Speakers#Healthcare Marketplace
0 notes
Text
Simple test could help predict risk of Alzheimer’s disease 20 years in advance - ANU
A simple, cheap and non-invasive blood test could help predict a person’s risk of developing Alzheimer’s disease up to 20 years before symptoms show. Physicists from The Australian National University (ANU) have come up with a way to use nanotechnology, combined with artificial intelligence (AI), to analyze proteins in our blood and search for signs of early neurodegeneration, or tell-tale…

View On WordPress
0 notes
Text

Alzheimer's Disease Puzzle: Delving into Pathogenesis Hypotheses
https://www.aginganddisease.org/EN/10.14336/AD.2023.0608
0 notes
Text
Therapien für Alzheimer: Was erwartet uns?
Trotz vieler vielversprechender Fortschritte bei der Behandlung der Alzheimer-Krankheit kommen neue Therapien nur langsam in Gang.
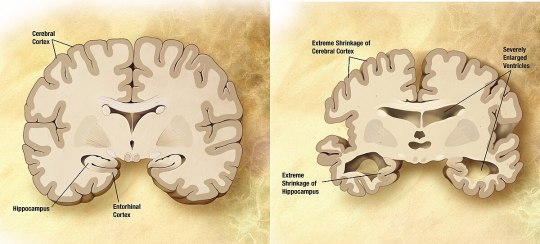
Vergleich eines gesunden Gehirns und eines Gehirns mit fortgeschrittenen Alzheimer-Schäden
Die derzeitigen Alzheimer-Therapien verbessern vorübergehend die Symptome des Gedächtnisverlusts und der Probleme beim Denken und Schlussfolgern.
Diese Alzheimer-Behandlungen steigern die Leistung von Chemikalien im Gehirn, die Informationen von einer Gehirnzelle zur anderen übertragen. Dazu gehören Cholinesterasehemmer und das Medikament Memantin. Diese Behandlungen können jedoch den zugrunde liegenden Verfall und das Absterben von Gehirnzellen nicht aufhalten. Je mehr Zellen absterben, desto weiter schreitet die Alzheimer-Krankheit fort.
Die Experten sind vorsichtig, aber hoffnungsvoll, was die Entwicklung von Behandlungen angeht, die das Fortschreiten der Alzheimer-Krankheit aufhalten oder verzögern können. Die Wissenschaft versteht immer besser, wie die Krankheit das Gehirn verändert. Dies hat zur Erforschung potenzieller Alzheimer-Behandlungen geführt, die den Krankheitsprozess beeinflussen können.
Künftige Alzheimer-Behandlungen könnten eine Kombination von Medikamenten umfassen. Dies ist vergleichbar mit der Behandlung vieler Krebsarten oder von HIV/AIDS, bei denen mehr als ein Medikament eingesetzt wird.
Die derzeitigen Alzheimer-Therapien verbessern vorübergehend die Symptome des Gedächtnisverlusts und der Probleme beim Denken und Schlussfolgern.
Diese Alzheimer-Behandlungen steigern die Leistung von Chemikalien im Gehirn, die Informationen von einer Gehirnzelle zur anderen übertragen. Dazu gehören Cholinesterasehemmer und das Medikament Memantin (Namenda). Diese Behandlungen können jedoch den zugrunde liegenden Verfall und das Absterben von Gehirnzellen nicht aufhalten. Je mehr Zellen absterben, desto weiter schreitet die Alzheimer-Krankheit fort.
Die Experten sind vorsichtig, aber hoffnungsvoll, was die Entwicklung von Behandlungen angeht, die das Fortschreiten der Alzheimer-Krankheit aufhalten oder verzögern können. Die Experten verstehen immer besser, wie die Krankheit das Gehirn verändert. Dies hat zur Erforschung potenzieller Alzheimer-Behandlungen geführt, die den Krankheitsprozess beeinflussen können.
Künftige Alzheimer-Behandlungen könnten eine Kombination von Medikamenten umfassen. Dies ist vergleichbar mit der Behandlung vieler Krebsarten oder von HIV/AIDS, bei denen mehr als ein Medikament eingesetzt wird.
Hier einige der Strategien, die derzeit untersucht werden.
Die Plaques ins Visier nehmen
Einige der neuen Alzheimer-Behandlungen zielen auf Verklumpungen des Proteins Beta-Amyloid, die so genannten Plaques, im Gehirn ab. Plaques sind ein charakteristisches Anzeichen der Alzheimer-Krankheit.
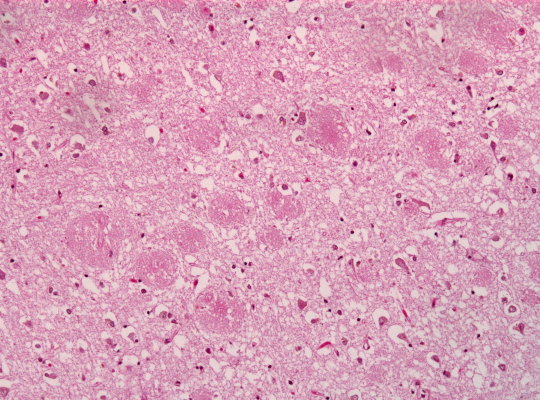
Amyloid-Plaques im Hirngebwebe
Zu den Strategien, die auf Beta-Amyloid abzielen, gehören:
Aktivierung des Immunsystems
Als monoklonale Antikörper bekannte Medikamente können verhindern, dass Beta-Amyloid zu Plaques verklumpt. Sie können auch bereits gebildete Beta-Amyloid-Plaques entfernen. Dazu helfen sie dem Körper, sie aus dem Gehirn zu entfernen. Diese Medikamente ahmen die Antikörper nach, die Ihr Körper natürlicherweise als Teil der Reaktion Ihres Immunsystems auf fremde Eindringlinge oder Impfstoffe produziert.
Im Juni 2021 hat die US-amerikanische Food and Drug Association (FDA) den monoklonalen Antikörper Aducanumab (Aduhelm) für die Behandlung der Alzheimer-Krankheit bei einigen Menschen zugelassen. Das Arzneimittel wurde bei Menschen mit früher Alzheimer-Krankheit, einschließlich Menschen mit leichter kognitiver Beeinträchtigung aufgrund der Alzheimer-Krankheit, untersucht.
Das Medikament wurde in den Vereinigten Staaten zugelassen, weil es die Beta-Amyloid-Plaques entfernt. Aber es wird nicht häufig eingesetzt. Die Studien über seine Wirksamkeit bei der Verlangsamung des kognitiven Verfalls sind uneinheitlich. Auch der Versicherungsschutz ist begrenzt.
Ein weiteres Alzheimer-Medikament, Lecanemab (Leqembi), hat sich als vielversprechend für Menschen mit leichter Alzheimer-Krankheit und leichter kognitiver Beeinträchtigung aufgrund der Alzheimer-Krankheit erwiesen. Die FDA hat das Medikament im Jahr 2023 zugelassen. Das Medikament wird über eine Infusion in den Arm verabreicht.
Eine klinische Studie der Phase 3 ergab, dass Lecanemab den kognitiven Abbau bei Menschen mit früher Alzheimer-Krankheit um 27 % verlangsamt. Das Medikament wirkt, indem es Beta-Amyloid-Plaques im Gehirn entfernt. Diese Studie war die bisher größte, in der untersucht wurde, ob die Entfernung von Beta-Amyloid-Plaques aus dem Gehirn den Krankheitsverlauf verlangsamen kann.
In einer weiteren laufenden Studie wird untersucht, wie wirksam Lecanemab bei Menschen mit einem Alzheimer-Risiko sein kann. Dazu gehören Menschen, die einen Verwandten ersten Grades, z. B. einen Elternteil oder ein Geschwisterkind, mit der Krankheit haben.
Donanemab, ein weiterer monoklonaler Antikörper, hat sich ebenfalls als vielversprechend erwiesen. Das Medikament wurde in eine Phase-3-Studie aufgenommen. Ergebnisse werden im Jahr 2023 erwartet.
Der monoklonale Antikörper Solanezumab zeigte jedoch keine Vorteile für Personen mit präklinischer, leichter oder mittelschwerer Alzheimer-Krankheit. Solanezumab senkte das Beta-Amyloid im Gehirn nicht, was der Grund dafür sein könnte, dass es nicht wirksam war.
Synapsen schützen
Ein ursprünglich als mögliches Krebsmittel entwickeltes Medikament - Saracatinib - wird nun bei der Alzheimer-Krankheit getestet.
Bei Mäusen schaltete Saracatinib ein bestimmtes Protein aus, wodurch die Synapsen wieder zu funktionieren begannen. Synapsen sind die winzigen Zwischenräume zwischen Gehirnzellen, über die die Zellen miteinander kommunizieren. Bei den Tieren in der Studie konnte ein gewisser Gedächtnisverlust rückgängig gemacht werden. Derzeit laufen Versuche mit Saracatinib als möglicher Alzheimer-Behandlung am Menschen.
Beta-Amyloid-Produktion verringern
Diese Therapien können die Menge des im Gehirn gebildeten Beta-Amyloids verringern. Die Forschung hat gezeigt, dass Beta-Amyloid in zwei Schritten, die von verschiedenen Enzymen ausgeführt werden, aus einem "Mutterprotein" gebildet wird.
Mehrere experimentelle Arzneimittel zielen darauf ab, die Aktivität dieser Enzyme zu blockieren. Sie sind als Beta- und Gamma-Sekretase-Inhibitoren bekannt. Jüngste Studien haben gezeigt, dass die Beta-Sekretase-Hemmer den kognitiven Verfall nicht verlangsamen. Außerdem waren sie mit erheblichen Nebenwirkungen bei Menschen mit leichter oder mittelschwerer Alzheimer-Krankheit verbunden. Dies hat den Enthusiasmus für diese Medikamente verringert.
Verklumpungen des Tau-Proteins verhindern
Ein lebenswichtiges Transportsystem der Gehirnzellen bricht zusammen, wenn sich ein Protein namens Tau in winzige Fasern verdreht. Diese Fasern werden Tangles genannt. Sie sind eine weitere häufige Veränderung in den Gehirnen von Menschen mit Alzheimer. Forscher suchen nach einer Möglichkeit, die Bildung von Tangles durch Tau zu verhindern.
Tau-Aggregationshemmer und Tau-Impfstoffe werden derzeit in klinischen Studien untersucht.
Entzündungen hemmen
Die Alzheimer-Krankheit verursacht eine chronische, schwache Entzündung der Gehirnzellen. Die Forscher untersuchen Möglichkeiten zur Behandlung der Prozesse, die bei der Alzheimer-Krankheit zu Entzündungen führen. Das Medikament Sargramostim (Leukine) befindet sich derzeit in der Forschung. Das Medikament könnte das Immunsystem dazu anregen, das Gehirn vor schädlichen Proteinen zu schützen.
Erforschung der Insulinresistenz
In Studien wird untersucht, wie Insulin das Gehirn und die Funktion der Gehirnzellen beeinflussen kann. Forscher untersuchen, wie Insulinveränderungen im Gehirn mit der Alzheimer-Krankheit zusammenhängen könnten. Bei einem Versuch mit einem Insulin-Nasenspray wurde jedoch festgestellt, dass das Medikament das Fortschreiten der Alzheimer-Krankheit nicht verlangsamen kann.
Erforschung der Verbindung zwischen Herz und Kopf
Es gibt immer mehr Hinweise darauf, dass die Gesundheit des Gehirns eng mit der Gesundheit von Herz und Blutgefäßen zusammenhängt. Das Risiko, an Demenz zu erkranken, scheint sich bei vielen Erkrankungen, die das Herz oder die Arterien schädigen, zu erhöhen. Dazu gehören Bluthochdruck, Herzerkrankungen, Schlaganfall, Diabetes und ein hoher Cholesterinspiegel.
In einer Reihe von Studien wird untersucht, wie man diesen Zusammenhang am besten ausbauen kann. Zu den untersuchten Strategien gehören:
Gängige Medikamente gegen Risikofaktoren für Herzkrankheiten. Forscher untersuchen, ob Blutdruckmedikamente Menschen mit Alzheimer helfen können. Sie untersuchen auch, ob die Medikamente das Demenzrisiko verringern können.
Medikamente für neue Ziele. In anderen Studien wird genauer untersucht, wie der Zusammenhang zwischen Herzerkrankungen und Alzheimer auf molekularer Ebene funktioniert. Ziel ist es, neue potenzielle Arzneimittel für Alzheimer zu finden.
Änderung des Lebensstils. Forschungsergebnisse deuten darauf hin, dass Lebensstilmaßnahmen, die bekanntermaßen für das Herz vorteilhaft sind, dazu beitragen können, der Alzheimer-Krankheit vorzubeugen oder ihren Ausbruch zu verzögern. Zu diesen Lebensstilentscheidungen gehören Sport und eine herzgesunde Ernährung.
Hormone
In den 1990er Jahren deuteten Studien darauf hin, dass die Einnahme einer Hormonersatztherapie während der Perimenopause und der Menopause das Risiko einer Alzheimer-Erkrankung senkt. Die weitere Forschung ist jedoch uneinheitlich. In einigen Studien wurde kein kognitiver Nutzen einer Hormonersatztherapie festgestellt. Weitere Forschungen und ein besseres Verständnis der Beziehung zwischen Östrogen und kognitiven Funktionen sind erforderlich.
Beschleunigung der Forschung
Die Entwicklung neuer Medikamente ist ein langsamer Prozess. Das Tempo kann für Menschen mit Alzheimer und ihre Familien, die auf neue Behandlungsmöglichkeiten warten, frustrierend sein.
Um die Forschung zu beschleunigen, hat das Konsortium Critical Path for Alzheimer's Disease (CPAD) in den USA eine Partnerschaft gegründet, um Daten aus klinischen Alzheimer-Studien auszutauschen. Zu den CPAD-Partnern gehören Pharmaunternehmen, gemeinnützige Stiftungen und Regierungsberater. CPAD hieß früher Coalition Against Major Diseases (Koalition gegen schwere Krankheiten).
CPAD hat auch mit dem Clinical Data Interchange Standards Consortium zusammengearbeitet, um Datenstandards zu entwickeln. Die Forscher sind der Ansicht, dass Datenstandards und die gemeinsame Nutzung der Daten von Tausenden von Studienteilnehmern die Entwicklung wirksamerer Therapien beschleunigen werden.
#Alzheimer#Demenz#Forschung#Alzheimer-Krankheit#Memantin#Aducanumab#Lecanemab#CPAD#TAU-Protein#Beta-Amyloid#Amyloid-Plaques
2 notes
·
View notes
Text
Alzheimer’s 'could be detected 20 years before dementia symptoms start to show'
Alzheimer’s disease could be detected up to 20 YEARS before dementia symptoms start to show following a significant breakthrough. Researchers have linked a specific type of body fat that surrounds vital organs in middle age to abnormal proteins in the brain that are hallmarks of the most common cause of dementia as early as two decades before the earliest symptoms appear. Scientists are regularly…
0 notes
Text
Stanford Reverses Cognitive Decline in Alzheimer’s With Brain Metabolism Drug
Neuroscientists at Stanford have Linked Alzheimer’s Disease to the Disruption of Brain Metabolism via the Kynurenine Pathway, which is Affected by Amyloid Plaque and Tau Proteins.
— By Stanford University | August 22, 2024

Stanford Researchers Have Found That Blocking the Kynurenine Pathway in the Brain Can Reverse the Metabolic Disruptions Caused By Alzheimer’s Disease, Improving Cognitive Functions in Mice. Credit: SciTechDaily.com
Alzheimer’s Disease and Brain Energy Metabolism
Their research has demonstrated that drugs blocking this pathway can restore cognitive function in Alzheimer’s mice by improving brain metabolism. This discovery not only bridges the gap between neuroscience and oncology but also provides a fast track to repurposing existing drugs for Alzheimer’s treatment.
Neuroscientists believe one of the key mechanisms by which Alzheimer’s disease impairs brain function is through the disruption of glucose metabolism, which is essential for energizing a healthy brain. Essentially, a decrease in metabolism deprives the brain of vital energy, thereby hindering cognitive functions and memory.
Against that backdrop, a team of neuroscientists at the Knight Initiative for Brain Resilience at Stanford’s Wu Tsai Neurosciences Institute have zeroed in on a critical regulator of brain metabolism known as the kynurenine pathway. They hypothesize that the kynurenine pathway is overactivated as a result of amyloid plaque and tau proteins that accumulate in the brains of patients with Alzheimer’s disease.
Restoring Cognitive Function in Lab Mice
Now, with support from research and training grants from the Knight Initiative, they have shown that by blocking the kynurenine pathway in lab mice with Alzheimer’s Disease, they can improve, or even restore, cognitive function by reinstating healthy brain metabolism.
“We were surprised that these metabolic improvements were so effective at not just preserving healthy synapses, but in actually rescuing behavior. The mice performed better in cognitive and memory tests when we gave them drugs that block the kynurenine pathway,” said senior author, Katrin Andreasson, a neurologist at the Stanford School of Medicine and member of the Wu Tsai Neurosciences Institute.
The study, which included collaborations with researchers at the Salk Institute for Biological Studies, Penn State University, and others, was published on August 22, 2024, in the journal Science.
Hungry Neurons
In the brain, kynurenine regulates production of the energy molecule lactate, which nourishes the brain’s neurons and helps maintain healthy synapses. Andreasson and her fellow researchers specifically looked at the enzyme indoleamine-2,3-dioxygenase 1 — or IDO1, for short — which generates kynurenine. Their hypothesis was that increases in IDO1 and kynurenine triggered by accumulation of amyloid and tau proteins would disrupt healthy brain metabolism and lead to cognitive decline.
“The kynurenine pathway is over activated in astrocytes, a critical cell type that metabolically supports neurons. When this happens, astrocytes cannot produce enough lactate as an energy source for neurons, and this disrupts healthy brain metabolism and harms synapses” Andreasson said. Blocking production of kynurenine by blocking IDO1 restores the ability of astrocytes to nourish neurons with lactate.
Potential Fast-Tracking of IDO1 Inhibitors
Best of all for Andreasson, and for Alzheimer’s patients, IDO1 is well known in oncology and there are already drugs in clinical trials to suppress IDO1 activity and production of kynurenine. That meant Andreasson could circumvent the time-intensive work of identifying new drugs and to begin testing in lab mice almost immediately.
In those tests, in which mice with Alzheimer’s Disease must navigate an obstacle course before and after drug intervention, Andreasson and team found that the drugs improved hippocampal glucose metabolism, corrected deficient astrocytic performance, and improved the mice’s spatial memory.
Promising Results Across Different Pathologies
“We also can’t overlook the fact that we saw this improvement in brain plasticity in mice with both amyloid and tau mice models. These are completely different pathologies, and the drugs appear to work for both,” Andreasson noted. “That was really exciting to us.”
Better yet, this intersection between neuroscience, oncology, and pharmacology could help speed drugs to market if proved effective in ongoing human clinical trials for cancer.
“We’re hopeful that IDO1 inhibitors developed for cancer could be repurposed for treatment of AD,” Andreasson stressed.
A Glimpse into the Future of Alzheimer’s Treatment
The next step is to test IDO1 inhibitors in human Alzheimer’s patients to see if they show similar improvements in cognition and memory. Prior clinical tests in cancer patients tested the effectiveness of IDO1 inhibitors on cancer but did not anticipate or measure improvements in cognition and memory. Andreasson is hoping to investigate IDO1 inhibitors in human trials for Alzheimer’s disease in the near future.
Reference: “Restoring hippocampal glucose metabolism rescues cognition across Alzheimer's disease pathologies” 22 August 2024, Science. DOI: 10.1126/science.abm6131
Stanford Wu Tsai Neurosciences Institute / Knight Initiative for Brain Resilience Authors:
Paras S. Minhas (co-lead), Amira Latif-Hernandez (co-lead), Aarooran S. Durairaj, Qian Wang, Siddhita D. Mhatre, Takeshi Uenaka, Joshua Crapser, Travis Conley, Hannah Ennerfelt, Yoo Jin Jung, Yeonglong Albert Ay, Matthew Matrongolo, Edward N. Wilson, Tao Yang, Marius Wernig, Frank M. Longo, and Katrin I. Andreasson (corresponding).
Other Contributing Institutions
The Salk Institute for Biological Studies (including co-lead author Jeffrey R. Jones), Keio University, Princeton University, Penn State University, UC San Francisco, and the Banner Sun Research Institute.
Wu Tsai Neurosciences Institute / Knight Initiative for Brain Resilience Support:
The research was supported by an Innovation Award and a Brain Resilience Scholar Award from the Knight Initiative for Brain Resilience at the Wu Tsai Neurosciences Institute. The study made use of Wu Tsai Neurosciences Institute Community Laboratories: the Stanford Behavioral and Functional Neuroscience Laboratory and the Stanford Neuroscience Microscopy Service, as well as the Stanford Mass Spectroscopy Core.
— Competing Interests: Andreasson is a Co-Founder, Board Member, and Consultant for Willow Neuroscience, Inc. Longo is a Founder of, Board Member of, and Consultant for and has Financial Interest in PharmatrophiX, a Company Focused on Small-Molecule Development for Treatment of Neurodegenerative Disorders.
#Stanford University#Reverses | Cognitive | Decline#Alzheimer#Brain Metabolism | Drug#Neuroscientists#Disruption | Brain Metabolism#Kynurenine Pathway#Amyloid Plaque | Tau Proteins#Cognitive Functions#Restoring | Cognitive Function | Lab Mice#Hungry Neurons#Fast-Tracking | IDO1 Inhibitors#Pathologists | Pathologies
1 note
·
View note
Text
One dose of a new treatment, delivered by nasal spray, clears away build-ups of the toxic tau protein associated with Alzheimer’s disease from inside brain cells, improving memory, according to new research. It paves the way for new treatments for the debilitating disease. A few years ago, abnormal clumps of tau proteins in the brain were found to be associated with Alzheimer’s disease. Since then, researchers have been working on a way of eradicating these toxic tangles, which have become a hallmark of the degenerative disease.
Continue Reading.
460 notes
·
View notes
Note
Wanted to give a bit of good news that was told today (7/11): Mice with Alzheimer's responded positively to a nasal spray invention. Here's the title - "Nasal spray found to clear tau proteins from Alzheimer's mouse model brains"
Found the paper for this:
thank you for submitting. I'll add this to my newsletter
279 notes
·
View notes
Note
Ok so headcanons but hassian.

You got it!
Hassian . . .
- absolutely cannot stand you when he first meets you; you seem to be like every other invasive human that reemerged
- acts coldly toward you, but secretly starts respecting you once you start engaging in Majiri traditions and bringing him gifts
- eventually starts opening up to you after you somehow weasel your way into his daily life
- pretends he's always annoyed by you, but only because you both adapted a dynamic where you're constantly bubbly and he's less than enthused; he clearly loves your attention either way
- can't get his mind off you when he's romanced
- is hesitant to be romantic with you at first, considering his cruel break-up with Tamala in the past. But you gradually let him know that you are nothing like her as you two continue bonding
- wants to learn more about your interests as much as he wants to share his
- wants to learn more about your culture; he secretly takes notes of whatever you can remember about your land and people
- writes secretly in general; little recordings of funny things you say or adorable things you do, a journal to rant about you in, and yes, meaningful poetry about you
- is completely head over heels if you're a proven hunter
- secretly talks with Tau about how crazy you make him feel; Tau doesn't say much (lol)
- values traditional Majiri romance, but also is curious about how humans court someone they admire; he'll ask and try to replicate any of the rituals, if he can
- is characteristically blunt when you explain pieces of your culture; he'll openly express his distaste for certain differences, although he tries to remain respectful
- is obsessed with your touch. Like, severely.
- feels his heart rate spike dramatically if you touch so much as his arm
- isn't reclusive when it comes to reciprocating physical affection; he'll just want your permission, first
- always makes a point to compliment you; it helps him come out of his shell a little and, hey, you look so precious when you light up and thank him
- smiles and laughs at any joke you make, no matter how stupid it is
- LOVES making you laugh; he's not much of a funny guy, so if he just so happens to say something that makes you laugh, he deeply blushes at the sound and chuckles with you
- as the relationship progresses, he feels terribly alone if he doesn't sleep next to you
- appreciates how you treat Tau as your own and likes to hear you talk to him, even if it's in a ridiculous high-pitched voice
- can cook, but mostly prepares proteins, so you'll have to cook the side dishes
- loves when you read to him, especially if it's one of the romance novels he's read a million times; hearing the stories told in your voice makes his heart rush all over again
- sleeps the best when he's on his back, holding you close with one arm and Tau in the other
- will sometimes not let you get up if you're spooning in the early morning; he will sleepily yet playfully tell you that you're not going anywhere until the sun comes up
#palia headcanon#palia headcanons#palia x reader#singularity 6#palia game#palia hassian#hassian palia#hassian#hassian headcanons#tsundere trad hunter go brrrrr
156 notes
·
View notes
Text
Sejak meyakinkan diri sendiri bahwa w tidak sedang dalam mode survival, gue belajar merawat diri dengan lebih baik. Makan dengan kalori yang tidak berlebihan. Tidak demonizing makanan. Berusaha tidur dengan baik, mandi dengan baik, rutin membersihkan kamar dan memikirkan prioritas hidup yang entah harusnya kemana.
Jujur gue bingung antara ambil S3 atau serius ngejar profesi jadi Game Designer. Tapi diri gue kalo lagi autopilot ya mode Game Designer. Even kalo ketemu orang di lift mulai beberapa kali disapa:
"Udah daftar PhD?"
Sama halnya dengan di rumah:
"Udah punya calon?"
Yang pada akhirnya ngebuat gue semakin paham bahwa yang pertama banget perlu kita pelajari dalam hidup adalah....
"Hiduplah untuk diri kamu sendiri dulu. Baru setelah itu pikirkan yang lain"
Menjalani hidup semacam ini ternyata bukan hidup yang egois. Karena andai kita mencintai seseorang dan pengen bertahan lama bareng dia, pertama banget kita butuh badan dan mental yang sehat 😅 Kalo mau PhD, perlu tau dulu apa yang mau kita cari. Meskipun ya nggak semuanya dapet Profesor yang beneran linear sama bidang risetnya.
Lupakan perkara PhD. Mungkin ini kelihatan cukup lebay karena gue sampe nyimpen beberapa jenis suplemen di laci meja. But it helps me a lot buat bertahan menjadi waras di tengah kesibukan.

Belakangan ini, gue tuh jaga makan banget. Ga makan gorengan sama sekali. Ga makan pedes. Double protein di piring dan selalu makan sayur. Gue juga mengurangi frekuensi ngopi maksimal 3 kali seminggu. Nggak kayak biasanya yang 2x sehari minum americano ato latte.
Gue minum vitamin B jadwal lagi padat-padatnya. Ternyata tidur gue lebih nyaman dan pencernaan gue lancar.
Gue juga beli produk buat ngerawat diri dan hiburan juga 😂 Sumpah gue happy banget kalo lagi capek terus mainin busanya Lovojoy. Lucu banget. Pink dan creamy. Thanks banget buat yang ngembangin produk Shower Mousse selucu ini


Meskipun gue berusaha biar badan dan otak gue bisa dipaksa kerja 12 jam tanpa stress, w masih berharap kelak jam kerja w berkurang, kebutuhan gue sama keluarga tercukupi dengan baik. Dan gue bisa masak makanan yang enak buat orang rumah.
Let's have a peaceful live, Dea!
87 notes
·
View notes
Text
Biologicals to have a lag-3 timelapse from spreading: the new strategy to prevent Parkinson onset
In studies with genetically engineered mice, Johns Hopkins Medicine researchers say they have identified a potentially new biological target involving APLP1, a cell surface protein that drives the spread of Parkinson’s disease-causing alpha-synuclein. The findings reveal how APLP1 connects with Lag3, another cell surface receptor, in a key part of a process that helps spread harmful…

View On WordPress
#alpha-synuclein#beta-amyloid#monoclonal antibody#neurodegeneration#nivolumab/relatlimab#Parkinson disease#tau protein
0 notes
Text
Researchers from Western and Brown University have made groundbreaking progress towards identifying the root cause and potential therapy for preeclampsia.
The pregnancy complication affects up to eight per cent of pregnancies globally and is the leading cause of maternal and fetal mortality due to premature delivery, complications with the placenta and lack of oxygen.
The research, led by Drs. Kun Ping Lu and Xiao Zhen Zhou at Western, and Drs. Surendra Sharma and Sukanta Jash at Brown, has identified a toxic protein, cis P-tau, in the blood and placenta of preeclampsia patients.
According to the study published in Nature Communications, cis P-tau is a central circulating driver of preeclampsia – a “troublemaker” that plays a major role in causing the deadly complication...
“The root cause of preeclampsia has (so far) remained unknown, and without a known cause there has been no cure. Preterm delivery is the only life-saving measure,” said Lu, professor of biochemistry and oncology at Schulich School of Medicine & Dentistry...
“Our study identifies cis P-tau as a crucial culprit and biomarker for preeclampsia. It can be used for early diagnosis of the complication and is a crucial therapeutic target,” said Sharma...
Until now, cis P-tau was mainly associated with neurological disorders like Alzheimer’s disease, traumatic brain injuries (TBI) and stroke. This association was discovered by Lu and Zhou in 2015 as a result of their decades of research on the role of tau protein in cancer and Alzheimer’s.
An antibody developed by Zhou in 2012 to target only the toxic protein while leaving its healthy counterpart unscathed is currently undergoing clinical trials in human patients suffering from TBI and Alzheimer’s Disease. The antibody has shown promising results in animal models and human cell cultures in treating the brain conditions.
The researchers were curious whether the same antibody could work as a potential treatment for preeclampsia. Upon testing the antibody in mouse models they found astonishing results.
“In this study, we found the cis P-tau antibody efficiently depleted the toxic protein in the blood and placenta, and corrected all features associated with preeclampsia in mice. Clinical features of preeclampsia, like elevated blood pressure, excessive protein in urine and fetal growth restriction, among others, were eliminated and pregnancy was normal,” said Sharma.
Sharma and his team at Brown have been working on developing an assay for early detection of preeclampsia and therapies to treat the condition. He believes the findings of this study have brought them closer to their goal...
“The results have far-reaching implications. This could revolutionize how we understand and treat a range of conditions, from pregnancy-related issues to brain disorders,” said Lu.
-via India Education Diary, September 22, 2023
#preeclampsia#maternal mortality#infant mortality#medical news#medical research#alzheimers#biology#pregnancy complications#good news#hope
321 notes
·
View notes
Text
Emerging signs of Alzheimer-like tau hyperphosphorylation and neuroinflammation in the brain post recovery from COVID-19 - Published Sept 29, 2024
Abstract Coronavirus disease 2019 (COVID-19) has been suggested to increase the risk of memory decline and Alzheimer's disease (AD), the main cause of dementia in the elderly. However, direct evidence about whether COVID-19 induces AD-like neuropathological changes in the brain, especially post recovery from acute infection, is still lacking. Here, using postmortem human brain samples, we found abnormal accumulation of hyperphosphorylated tau protein in the hippocampus and medial entorhinal cortex within 4–13 months post clinically recovery from acute COVID-19, together with prolonged activation of glia cells and increases in inflammatory factors, even though no SARS-COV-2 invasion was detected in these regions. By contrast, COVID-19 did not change beta-amyloid deposition and hippocampal neuron number, and had limited effects on AD-related pathological phenotypes in olfactory circuits including olfactory bulb, anterior olfactory nucleus, olfactory tubercle, piriform cortex and lateral entorhinal cortex. These results provide neuropathological evidences linking COVID-19 with prognostic increase of risk for AD.
#long covid#covid conscious#mask up#covid#pandemic#wear a mask#covid 19#coronavirus#public health#still coviding#sars cov 2#wear a respirator#covid is airborne
41 notes
·
View notes