#légzési kontroll
Explore tagged Tumblr posts
Video
youtube
0 notes
Photo

Megnyerő egyéniség
Az INPRESS study végre egy pozitív vizsgálat. Ha elfogadjuk a következtetését, akkor magas rizikójú betegeink jobban járnak, ha preoperatív értékek alapján, szorosan, +-10%-on belül tartjuk a vérnyomásukat a műtét alatt.
De elfogadjuk?
Háttér: több retrospektív vizsgálat szerint az alacsonyabb vérnyomás, alacsonyabb MAC és alacsony BIS összefügg (triple low) a mortalitással. Ezen belül a vérnyomás kiemelten fontosnak tűnt. De, hogy a vazopresszorral korrigált vérnyomás segít-e, vagy mi az ideális vérnyomás cél, hiába mindennapi kérdés, érdemi vizsgálat eddig nem történt.
Francia multicentrikus vizsgálat 2012- 2016
Beválasztási kritériumok:
50 év feletti, legalább ASA 2 betegek
2 órán túl tartó műtét
Magas AKI rizikó (külön score alapján. Megnéztem logikusnak tűnik)
Kizárták:
Kezeletlen vagy terápia rezisztens súlyos magasvérnyomásbetegség
Krónikus veseelégtelenség GFR 30 alatt
Sokkos vagy szeptikus betegek
Preoperatív noradrenalin infúzió
Epidurális vagy spinális érzéstelenítés (posztop epidurál lehetett)
Intervenció:
Az alábbiak a műtét alatt és utána 4 óráig folytatódtak
Egyéni vérnyomáskontroll: ezeknél a betegeknél a referencia vérnyomásukat az aneszteziológiai ambulancián vagy a műtét előtti napon a sebészeti osztályon vették fel.
A műtét alatt noradrenalin segítségével tartották a fenti érték és +\- 10%-os értékek között.
Kontroll csoport: 80 alatti SBP vagy a „szokásos” vérnyomásnál 40%-al kisebb érték esetén ephedrin bolusokat adtak (6mg, 60mg-ig). Ezt követően itt is lehetett noradrenalint használni.
Mindkét csoportnál:
4ml\kg\h Ringer laktát, folyadék fenntartásnak
Cél vezérelt folyadék terápia: 250ml 6% HES bolusok, amíg a Stroke Volume Index 10%-al nő. Expliciten nincs megemlítve, milyen hemodinamikai monitort használtak.
Elsődleges végpont: egy összetett végpontot használtak a posztoperatív 7. napig. Ez SIRS és egy szervelégtelenség kombinációját jelentette, ami lehetett:
AKI (RIFLE definíció)
Légzési elégtelenség (posztoperatív lélegeztetési igény, pneumonia, ards)
kardiovaszkuláris (szívelégtelenség, ischaemia, infarktus)
neurológiai (stroke vagy GCS <= 14)
alvadás (SOFA szerint).
Ezeket naponta mérték minden betegnél.
Power kalkuláció: 20% különbséghez 268 beteg kellett
Betegek
300 beteget választottak be, amiből végül 292 került bele a végső analízisbe.
70 éves átlagéletkor, 85% férfi
85% elektív műtét, 95% hasi sebészeti
kb. 40% ASA 2, 60% ASA 3, 80% magasvérnyomásbeteg, hasonló gyógyszereket szedtek, hasonló vesefunkciójuk volt
Referencia vérnyomás átlag 135\75
Apróbb különbségek: több krónikus vesebeteg (19% vs 11%) az egyéni vérnyomásvezérelt csoportban, viszont kevesebb szívelégtelen (17% vs 26%)
Mi történt?
A folyadék és perctérfogat tekintetében nem volt jelentős különbség.
Az egyéni csoport 4.1%-a és a kontroll csoport 15%-ának nem volt szüksége vazopresszorra.
A kontroll csoport 26%-nak volt szüksége noradrenalinra efedrin után.
Magasabb volt az átlag vérnyomás az egyéni csoportban, pl.: SBP 123 vs 116, de diasztolés és középnyomásban az intervenció teljes hossza alatt megmutatkozott. ld. alább.
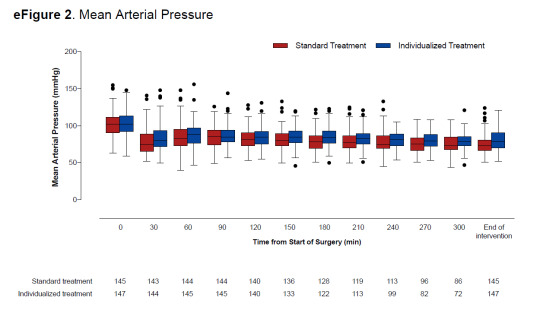
Eredmények
Az összetett elsődleges végpont szignifikánsan alacsonyabb volt az intervenciós, szoros vérnyomás kontrollált csoportban: 38.1% vs 51.7% RR 0.73 p0.02
Mivel ez egy összetett végpont különösen fontos ennek a felbontása:
SIRS-ben nem volt lényeges különbség
A RIFLE szerinti AKI szignifikánsan több volt
A GCS-beli különbség is szignifikáns volt (5.4% vs 15.9%)
A koagulációban nem szignifikáns különbség volt az intervenciós csoport hátrányára (11% vs 7.6%)
Nem szignifikánsan több hypoxia (14 vs 22%) és pneumonia (2.7 vs 7.6%), reintubáció (6.8% vs 10.3%) és ARDS, valamint NIV igény (17% vs 24.8%)
Nem szignifikánsan több szeptikus epizód 15% vs 26.2%
Szignifikánsan kevesebb sebfertőzés (15.7% vs 24.8%) p0.05
Kórházi mortalitás (6.1% vs 5.5%) és tartózkodás tekintetében nem volt szignifikáns a különbség
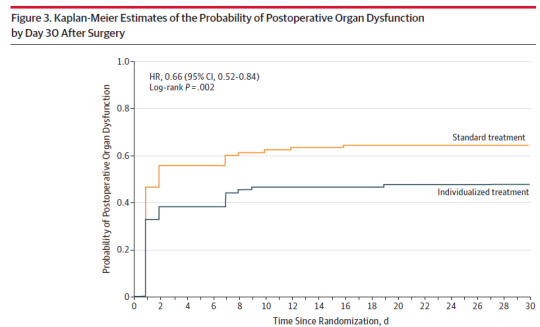
Összefoglalás
Alapvetően jól megtervezett és kivitelezett vizsgálattal állunk szemben. Legfőbb erénye, hogy nem fix vérnyomáskontrollt tesztelt, hanem egyéniesített, a preoperatív értékhez viszonyítva vezette az anesztéziát. Az, hogy elég erős-e, hogy gyakorlatunkat megváltoztassa, az leginkább a végpontok értelmezésén múlik.
Érv a szoros vérnyomás kontroll mellett
Noha mortalitásra nem volt hatással az intervenció, a vesekárosodás és légzési szövődmények elég ok lehet a szorosabb vérnyomáskontrollra, különösen hozzátéve a sebfertőzéseket. Kórélettani alapja is van a vazopresszorok használatának, hiszen az anesztetikumok vazodilatációt okoznak, mely mindig az intraoperatív hipotenzió egyik jelentős eleme. Logikus, hogy ezt vazopresszorral korrigáljuk. Egészséges fiatal betegek arthroscopiája közben valószínűleg nem számít a 70-es tenzió sem, de egy 70 éves cukor- és vesebeteg ember hemikolektómiájánál, már lehet, hogy az a 2 óra alacsonyabb vérnyomás is elég lehet, hogy a perfúzió csökkenésével vesekárosodás vagy más szervkárosodás alakuljon ki. Ráadásul a noradrenalin olcsó, kevés mellékhatással járó terápia. Rövid ideig tartó adagolásához nem szükséges centrális véna és persze lehet, hogy bolus vazopresszorral is helyettesíthető.
Érv a lazább kontroll mellett
A vizsgálat mortalitás különbséget nem talált, az összetett végpont pedig felnagyíthatta az intervenció terápiás hatását. A vesekárosodásból csak a könnyen reverzibilis R és I különbözött szignifikánsan, ja meg a GCS < 14, ami nem világos, hogy mennyire releváns. Az összes többiben csak nem szignifikáns különbség volt.
A korábbi triple low vizsgálatok egyértelműen megmutatták, hogy az intraoperatív alacsony vérnyomás egyik legfontosabb oka a beteg betegségei és állapotának súlyossága. Nyilván fontos, hogy ne csökkenjen nagyon a vérnyomás, a 80-as érték talán túl alacsony, de egy 100 vagy 90-es célérték mellett már valószínűleg ebben a vizsgálatban sem találtak volna különbséget.
Szerinted?
http://jamanetwork.com/journals/jama/fullarticle/2654895
0 notes
Photo

Ki az a Charlie Gard?
Charlie Gard egy mitokondriális betegséggel született rossz prognózisú brit gyermek, akinél véleménykülönbség bontakozott ki a szülők és a kezelő kórház között az életminőség és kilátásokat illetően. A szülők az Egyesült Államokban szerettek volna egy kísérleti kezelést, míg a kórház Charlie súlyos agykárosodására tekintettel az életfenntartó kezelés felfüggesztése mellett érvelt és bírósághoz fordult. Végül a brit és európai bíróság végzése alapján július 27-én Charlie lélegeztetését felfüggesztették és 28-án meghalt. Ez eset Ferenc pápától, Trumpig nagy médiavisszhangot váltott ki, ám ennél fontosabb, hogy érdekes etikai és jogi kérdéseket feszeget… különösen itthon.
A történtek
Charlie 2016 augusztus 4-én született. Légzési elégtelenség miatt néhány hónapos korában a Great Ormond Street Hospital (GOSH) intenzív osztályára került. Itt novemberre genetikai vizsgálatokkal egy ritka mitkondriális DNS depléciós betegséget diagnosztizáltak (MDS).
Ezek autoszomális recesszíven öröklődő genetikai rendellenességek melyek a mitokondriális DNS szintézisének zavarával járnak és az érintett szövetekben a mitokondrium által termelendő ATP hiányában funkcióvesztést okoznak. A leggyakrabb típusok az érintett szövetek szerint: Myopátiás, Encephalomyopátiás, hepatocerebrális és neurogastrointestinális. Charlienak az RRM2B fehérjén volt mutációja, mely izom és központi idegrendszeri érintettséggel jár. Ez csecsemőkorban halálos, bevállt kezelése nem ismert.
A diagnózist követően alakult ki véleménykülönbség a család és az ellátó kórház között Charlie állapota és a terápiás fókuszt illetően. Noha Charlie még lélegeztetőgépen volt és a leszoktatásra nem volt remény, a diagnózis ismeretében a kórház etikai bizottsága novemberben elutasította tracheosztóma készítését.
Decemberben a család egy amerikai MDS specialistával Dr Michio Hiranoval vette fel a kapcsolatot a New Yorki Columbia Egyetemi Kórházban. Dr Hirano nukleozid pótló kezelést vizsgált a betegségcsoport (MDS) egy más gén mutációja által okozott (TK2), enyhébb formában. Noha a kezelést még Charlie betegségében nem alkalmazták, Dr. Hirano véleménye az volt, hogy elképzelhető, hogy segíthet, így a két kórház elkezdte az együttműködést a kezelés kivitelezése érdekében és a tracheosztóma is újra az asztalra került.
Január elején azonban Charlienál status epilepticus alakult ki és képalkotón súlyos agykárosodás jelei látszottak. Ennek fényében a GOSH orvosai arra jutottak Charlie visszafordíthatatlan agykárosodása miatt, nem csak a speciális kezelés nem jön szóba, hanem további életfenntartó kezelés is eredménytelen, sőt Charlienak csak fájdalommal járhat és a szülőknek az életfenntartó kezelés felfüggesztését kommunikálták.
A család és a kezelő csapat között eddigre jelentős véleménykülönbség alakult ki Charlie állapota és prognózisát illetően. A család úgy vélte, Charlie az ő érintésükre reagál és nemhogy palliatív ellátásról nem akartak hallani, de továbbra is a nukleozid terápiát szerettek volna. A GoFundMe oldalon sikerült is a kezeléshez szükséges 1.3 millió font összegyűjtése.A GOSH februárban a bírósághoz fordult az ügyet illetően. Az Április 11-én megszületett ítélet szerint Charlie-nak az szolgálja leginkább érdekét, ha abba hagyják a gépi lélegeztetést és csak palliatív kezelést kap. A fellebbezést követően a fellebbviteli bíróság május 25-én ismét elutasította a kezelés folytatását. Ezt követően az Európai Emberi Jogok Bírósága is megerősítette a döntést.Közben a többen megszólaltak az ügyben: Trump „szívesen segített” volna és Ferenc Pápa és Charlie kezelésének folytatása mellett foglalt állást. Két kórház is a vatikáni Bambino Gesú és a NewYork Presbyterian Hospital is felajánlotta Charlie további kezelését. Dr. Hirano pedig úgy nyilatkozott, hogy friss alapkutatási adatok alapján a kezelés talán hasznosabb lehet, mint gondolták.
Júliusban a család új információra hivatkozva ismételt meghallgatást kért az angol bíróságtól. A bírósági végzés alapján újabb megbeszélések voltak a GOSH és Hirano között. Ezen kívül további MR-ek is készültek. A GOSH kritizálta Hirano-t, amiért fizikailag még nem vizsgálta meg Charlie-t és mivel pénzügyi érdeke fűződött a kezeléshez. Válaszul Hirano lemondott részesedéséről, amit a kezelés elvégzése esetén kapott volna.
Az MR és más eredmények alapján azonban úgy tűnt, hogy a myopátia olyan előrehaladott volt, hogy nem volt esély rá, hogy a nukleozid kezelés hatásos legyen.Július 24-én a család visszavonta kérvényét a gyerek kezelését illetően. Charliet végül Július 27-én helyezték egy gyermek Hospiceba, ahol a lélegeztetés felfüggesztésével másnap meghalt.
Az ügynek rengeteg érdekes jogi-etikai pontja van, melyeket hely és megfelelő szakértelem hiányában csak felvetni tudok.
1. Kísérleti kezelés potenciális haszna vagy kára
Érv a kezelés mellett:Ritka betegségek drága kezelése esetében nagyon nehéz randomizált kontroll csoportos vizsgálatot végezni. Charlie esetében a kezelés rajta és a társadalmon is segíthetett volna.Charlie túlélési esélye kezelés nélkül nulla, azzal ennél csak több lehet. Mit veszthet?
Érv a kezelés ellen: A kezelés és életfenntartó kezelés rengeteg fájdalommal és kellemetlenséggel jár, az állapotjavulás (és nem jó életminőség) esélye elhanyagolható. Erre nem etikus Charlie-t használni, még a társadalom érdekében sem. Charlie dönthetett volna ebben a kérdésben, vállalva a szenvedéseket, de állapota miatt nem tudott, így másoknak kellett dönteni.
2. Család vs Orvos
Érv a Család mellett: Elsősorban a beteg dönt az életét befolyásoló kérdésekben, ám ha a beteg erre képtelen (és gyám, advance directive sincsen) akkor a hozzá közel állók, tipikusan a családja, aki leginkább hivatott ebben dönteni. Miért ne vihették volna el Charliet szülei az USA-ban, ha egyszer ott vállalták a kezelést és a pénzügyi fedezet is megvolt?
Érv az Orvos mellett: az orvos első számú kötelezettsége a beteg jólétének biztosítása. A jog lehetőséget biztosít ennek a szülőkkel szembeni érvényesítésére Magyarországon is. Ennek tipikus példája a gyermekbántalmazás. Bár ennek alkalmazása abszurdnak tűnhet, de a GOSH csapata úgy gondolta, hogy a további kezelés csak szenvedést okozna Charlienek, érdemi esélyt reális életminőségre nem.
3. Lélegeztetés visszavonása
Magyarországon az életvégi döntések jogi szabályozása igencsak elmaradott. Az kezelés visszavonása jogilag nem lehetséges, sőt a terápia limitáció is csak igen körülményesen. Ennek megfelelően nem dokumentáltan, szürke szokáselvek mentén, sokszor rossz kommunikációva történnek az ilyen döntések. Mint látható nincs ez így Nyugat-Európában, különösen nem Nagy-Britanniában, ahol talán a legjobb a palliatív ellátás a kontinensen. A GOSH csapat követte a lelkiismeretét, a szakma szabályait és a törvényt. A családdal felmerülő nézetkülönbség esetén először az etikai bizottsághoz fordult, majd bírósgához, végül nemzetközi bírósághoz. Egyszerűbb lett volna egy éjszaka „meghalasztani” vagy tracheosztómával krónikus osztályra kiadni meghalni.
4. A kommunikáció fontossága
A családdal való jobb kommunikációval megelőzhetőek lettek volna a sorozatos perek? Számít, hogy a Pápa, Trump vagy a Többség mit gondol a kérdésről?
0 notes
Photo

Ismeretlen vizeken
Nyugati típusú folyadék reszuszcitáció Zambiában
Miért érdekelne egy vizsgálat olyan körülmények között, melyek drasztikusan különböznek az itthonitól?
Először is ez egy USA, UK vezetéssel készült study; a Zambiai helyszín pedig olyan kezelési stratégia vizsgálatát teszi lehetővé, ami fejlett országokban már ’standard of care’ és így etikai szempontból nehezen lenne elvégezhető. Mindemellett rengeteg olyan dolgot csinálunk, ami nem volt soha RCT keretein belül bizonyítva. Ilyen a folyadék reszuszcitáció is. Ahogy egyre többet tudunk meg a folyadék terápiáról, egyre több kérdés merül fel a jelenlegi stratégiánk kapcsán.
A vizsgálat előképei a FEAST vizsgálat, ahol – jórészt Maláriás – szeptikus afrikai gyermekeknél tűnt károsnak a folyadék reszuszcitáció. Majd ugyanezen vizsgáló csapatnak a korábbi vizsgálata, ahol szeptikus betegeknél végeztek folyadékreszuszcitációt, de az intervenciós csoportban magas mortalitás miatt félbe szakították. Azért vágtak neki másodszor is a vizsgálatnak, mert egy alcsoportban, szeptikus és hipotenzív beteg között szerették volna tesztelni a folyadék reszuszcitáció hatékonyságát, gondolván, hogy ők azok, akik profitálhatnak ebből.
Részletek:
2012-2013, Zambia
Bevonás: szeptikus sokkos betegek: fertőzés, SIRS és BP < 90 vagy MAP < 65
Kizárás: légzési probléma (Sat < 90%, RR > 40), vérzés, szívelégtelenség, emelkedett JVP, műtét
Intervenció:
Mindkét csoportban egy órán belül igyekeztek hemokultúrát venni és antibiotikumot adni.
Elsődleges végpont kórházi mortalitás volt.
Power analízis: 65% mortalitásról 20% csökkenéshez 212 beteg kellett.
SSSP (egyszerűsített szepszis protokoll): 2l krisztalloid 1 órán belül, majd 4 órán belül további 2l
Óránként betegvizsgálat, ha szaturáció csökkent (3%) vagy nőtt a JVP (3cm), akkor a folyadék terápiát megállították.
Ha 2l folyadék után még hipotenzívek voltak, akkor dopamin infózió MAP > 65-t célozva (csak ez volt elérhető)
Kontroll csoportban nem volt megkötés.
Eredmények
382 beteget felelt meg a bevételi kritériumoknak, ebből 170-et zártak ki, leginkább tachypnoe és hypoxia miatt. Végül 212-t randomizáltak, 209 került be az analízisbe.
Ez bizony egy másmilyen betegpopuláció volt. 36-37 éves átlagéletkor, kicsit több férfi.
88-90% HIV pozitív (CD4 szám 65-72, fele antiretrovirális szeren).
Közel felének volt már TBC-je, negyede most is szed antituberkulotikumot.
A kórházban nem volt rutinszerűen elérhető mérleg (!), így karkörfogattal következtettek a tápláltsági állapotra, ez medián 20cm volt, ami meglehetősen alultápláltat jelent.
SAPS 33 55, 80\50 átlag vérnyomás, medián laktát 4.3
Nem volt különbség a bevonáskor a két csoport között
Milyen intervenciók történtek
Mindkét csoportban 2 órán belül antibiotikumot kaptak (medián), ami egy nyugati sürgősségin is jó eredmény lenne.
1 beteg kivételével nem kerültek ITO felvételre helyhiány miatt. A kórházban volt az ország egyetlen intenzív osztálya: 10 ággyal, kb. másfél Magyarországnyi emberre. Ez azt is jelenti, hogy gépi lélegeztetés nem volt elérhető ezeknek a betegeknek.
Mindkét csoportban kb. 20%-ban volt a hemokultúra mycobactérium pozitív. Egyebekben 1-2% malária és hasonló mennyiségű cryptococcus fertőzést leszámítva szokásos kórokozókat találtak.
Több folyadékot (3.5L vs 2L 6 órán belül, 4L vs 3L első nap) és dopamint (14.2% vs 1.9%) kaptak a szepszis protokollban. A vérnyomás mindkét csoportban emelkedett és a laktát csökkent mindkét csoportban, de gyorsabban a protokolizált csoportban.
A szepszis protokollt kapó csoportban a folyadék adását fel kellett függeszteni 4l előtt 61.3%-ban. Erre leginkább (30%) szaturáció esés miatt volt szükség.
Szignifikánsan magasabb volt az agresszív folyadékreszuszcitációban részesülő csoport kórházi mortalitása: 48.1% vs 33%, RR 1.46, p0.03. A 28 napos mortalitás is szignifikánsan több volt: 67% vs 45%.
Hogy miért?
Légzési probléma (deszaturáció 3%-al vagy RR növekedés 5-el) gyakrabban fordult elő folyadék mellett: 35.8% vs 22.3%
Összefoglalás
Azon túl, hogy a vizsgálat direkt tanulsággal szolgál fejlődő országoknak és a Surviving Sepsis Guideline rájuk vonatkozó részei számára, számunkra is érdekes lehet.
Óvatos, visszafogott folyadék reszuszcitáció előnyösebb gépi lélegeztetési lehetőség híján, illetve HIV-es, alultáplált betegeknél. Ez nálunk is releváns lehet például terápia limitált betegeknél.
A vizsgálat egyértelműen a helyi erőforrások hiánya miatt nem tárja fel pontosan mi történt ezekkel a betegekkel, sem a fiziológiás paraméterek változását, sem a háttérben álló patológiát, mindössze egy dolgot dobva fel, feltehetően légzési problémához vezetett a folyadék reszuszcitáció.
A vizsgálat elgondolkodtat, hogy hova is megy a – sokszor 5-10 liter – folyadék, amit beadunk. Úgy tűnik mindensetre, hogy nem az érpályában marad. Sajnos azonban egyenlőre nagyon kevés egyéb eszköz van a kezünkben. Folyadékkal és katekolaminokkal mindössze a makrohemodinamikára van érdemi hatásunk. Keveset tudunk és érdemben mérni sem tudjuk a mikrohemodinamikát, elképzelésünk sincs a kapillárisok glikokalixának állapotáról vagy a sejtszintű energetikai változásokról – nemhogy kezelési lehetőségünk.
UPDATE: Kommentár Paul Mariktól az EMCriten:
This study clearly demonstrates that an aggressive approach to fluid administration, mirroring the recommendations of the Surviving Sepsis Campaign, increases the risk of death in patients with SEPTIC SHOCK. The protocol patients received a 2L bolus within 1 hour of enrollment, followed by an additional 2 liters over the subsequent 4 hours. This strategy is remarkably similar to those of the Surviving Sepsis Campaign, namely “1) We recommend that, in the resuscitation from sepsis-induced hypoperfusion, at least 30 mL/kg (2L in 70kg patient) of IV crystalloid fluid be given within the first 3 hour. 2) We further recommend that, following initial fluid resuscitation, additional fluids be guided by frequent reassessment of hemodynamic status.”Septic shock is a consequence of profound vasodilatation. Fluids (in themselves) cannot reverse vasodilatory shock, and indeed in the setting of sepsis fluid boluses may cause further vasodilatation. Attempts at restoring blood pressure in septic shock with aggressive fluid administration reflects a complete lack of understanding of human physiology and is reckless behavior. Furthermore, the hemodynamic benefit of those who actually respond to fluids (only 50% of patients) is short lived, being about 30 minutes at best and 10 minutes at worst with a minimal increase in blood pressure and no evidence that it increases urine output. The net effect is the rapid transfer of fluid from the IV bag into the tissues.The religious followers of the Surviving Sepsis Campaign Guidelines (2004, 2008, 20012 and 2016) will argue that the patients in the current study are not typical of sepsis patients around the world. This is not correct. The pathophysiology of sepsis is similar whether the patient is in Africa or in Europe… vasodilatory shock is vasodilatory shock and this condition is not a fluid responsive condition. Furthermore, they may argue that the Surviving Sepsis Guidelines are not recommended for patients in resource-poor settings. This is however again completely wrong. Dr JL Vincent has publically stated that “these guidelines are not for you (meaning me), these guidelines are not for me (JLV), No My Friends, they are for the non-expert clinician (in resource poor settings). Dr Machado (the co-author of the accompanying editorial) has vigorously endorsed the use of the Surviving Sepsis Campaign in resource limited settings. However, the evidence is clear: a protocol of aggressive fluid administration kills septic patients by “salt water drowning”.
http://jamanetwork.com/journals/jama/fullarticle/2654854
https://emcrit.org/isepsis/isepsis-death-fluids-part-1/
0 notes