#hydroxil
Explore tagged Tumblr posts
Text
Anti-Bacterial Spray Acquiring Overview: Properties, Efficiency & More

Applying suited disinfectant sprays regularly on surfaces almost everywhere in your skin layer, home, or even workplace is actually considerable in stopping the magnitude of health problems as well as diseases. As there are several disinfectant sprays on call out there, it's critical to recognize concerning them.
You may wipe the floor and vacuum, yet you are going to still demand a desinfektionsmittel spray to clean the remaining wreck as well as discolorations. A disinfectant spray is a buddy in the required hr. They certainly not only tidy up the tacky elements on your table tops or sides, but they additionally assistance in purifying your place and ruining the bacteria present in the environment. These disinfectant sprays are actually thus helpful as they can be put on all regions, including your cooking area surface area or commode seats, probably even on your palm.
As the germs sprays are functional, it can end up being somewhat challenging to choose which one to acquire and also wherefore purpose? Right here is actually the buying resource to aid you in understanding everything regarding the anti-bacterial sprays that cleanse area and surroundings:
Exactly What is actually a desinfektionsmittel spray?
Disinfectant sprays are actually biochemical equipments generated to eliminate bacteria, featuring microorganisms, germs, and so on, on still areas. They are frequently made use of in health centers, dental functions, home kitchens, as well as washrooms to kill discolorations and also bacteria. Some sprays fulfill different features like sanitizing palms and cleansing soft areas.
Just What are actually the buildings of a really good disinfectant spray?
* Sanitize the outsides and surroundings
* Non Corrosive
* Safe on animals and also human beings' skin
* Ecologically risk-free
* Leaves behind no stains, damages or uncomfortable odor
When applied, * Carry out certainly not generate a severe chemical reaction
* Helpful as well as valuable
* Available at an affordable cost
Things to look at prior to getting an anti-bacterial spray:
Effectiveness
Always seek a händedesinfektionsmittel spray according to your needs as well as necessities. Numerous disinfectants can kill the micro-organisms as well as germs that are of prime worry in your vicinity. Some disinfectant sprays are actually only beneficial in clearing away filth from a soft surface area or even skin.
Efficiency
youtube
30 secs to five moments are essential for it to remain wet on the area to timely eliminate the germs since of the existence of chemical substances in the anti-bacterial spray. When required, keep in mind that it is actually vital to check out as well as comply with the directions while applying and also rewet simply.
Kind of area to be washed
Decide on the appropriate disinfectant spray that may cleanse all the areas and also settings featuring smooth area, hardbound, lavatory seat and also buttons, devices' area, and bed linen as well as garments, which is actually safe on fingers and can easily remove unwanted air-borne particles.
Secure to make use of
Inspect alcohol as well as chemical attention on the item. Steer clear of any type of type of acrid or hazardous anti-bacterial spray that may result in damages to any type of surface area it is actually used on.
Relaxed to use
Majority of disinfectant sprays decontaminate in only a singular step and also can address a vast range of micro-organisms, bacteria, moulds as well as rust in medical facilities, institutions, institutions, etc. Possessing a strong planning that may cease diseases as well as spare your initiatives and cash.
Exactly how to sanitize residence's contact surface area?
Rub the areas, getting rid of any kind of germs, dirt, or even garbage. Germs can be existing on doorknobs, desk areas, eating seats, kitchen area counters, washroom shelves, bathroom seats and a lot more places. After rubbing, apply the hydroxil spray that fits the surface.
For how long can disinfectant spray be actually made use of?
It normally takes about two years after its manufacturing time to expire. Some may lose their convenience after a year or so, as a result of the dissolution of the chemical compounds.
0 notes
Photo

Alkoholfreie Desinfektionsmittel sind eine brauchbare Alternative zu den allgegenwärtigen Produkten auf Alkoholbasis. Sie sind ebenso wirksam gegen Mikroorganismen, haben aber den Vorteil, dass sie einen länger anhaltenden Schutz auf der Haut bieten, hautverträglicher und insgesamt sicherer sind.
HYDROXIL - Alkoholfreies Desinfektionsmittel - wirkt 99,99%* gegen Bakterien, Keime, Sporen, und Viren wie z.B. den aktuellen CORONAVIREN (Sars-CoV-2). HYDROXIL ist ohne Alkohol und dadurch nicht brennbar. Es ist ohne Phenole, Tenside, Farb- und Duftstoffe und kein Gefahrengut (lt. CLP-Verordnung 1272/2008)
0 notes
Text
Chimie du vivant : les composants élémentaires
La chimie du vivant est un sujet passionnant. Et tout aussi passionnante est la quête des origines de la chimie du vivant. Nous sommes tous composés des mêmes atomes : du carbone, de l’azote, de l’oxygène, de l’hydrogène, une pincée de minéraux divers… Tous ces éléments, à l’exception de l’hydrogène issu directement du Big-bang, ont été forgés dans de lointaines étoiles et se sont dispersés lorsque celles-ci ont explosé (voir le post sur la nucléosynthèse). Ces matériaux sont ensuite recyclés dans de nouvelles étoiles. Lors de la formation de ces nouvelles étoiles, des grains de matière laissés pour compte par celles-ci s’agglutinent pour former des planètes (voir le post sur la formation du système solaire). Et parmi ces grains de matière se trouvent les atomes dont nous sommes formés. Pour citer la formule de Carl Sagan reprise par Hubert Reeves, nous sommes tous des poussières d’étoiles.
Dans le post précédent, nous avons rappelé quelques bases de la chimie : liaisons chimiques, réactions acide-base et oxydoréduction. Ce post sera consacré aux principales propriétés des éléments chimiques intervenant dans la chimie du vivant. Mais avant d’entrer dans le vif du sujet, quelques mots sur l’abondance de ces éléments dans l’Univers. Pourquoi parler de l’abondance des éléments dans l’Univers ? Tout simplement parce que si l’on met de côté l’hypothèse créationniste, l’abondance de ces éléments est un facteur décisif dans la probabilité d’émergence de cellules vivantes. Plus les éléments sont abondants, plus leur probabilité de réagir entre eux et de constituer des composés complexes est grande. Et si ces composés complexes sont eux aussi abondants, ils réagissent à leur tour entre eux pour former d’autres composés et ainsi de suite…
Abondance des éléments chimiques dans l’Univers
L’hydrogène (H) et l’hélium (He) sont de loin les éléments les plus abondants dans l’Univers. Ils sont tous deux issus de la nucléosynthèse primordiale. L’hydrogène représente 76% de la matière ordinaire (on parle de matière baryonique) et l’hélium 22%. Viennent ensuite la trilogie carbone (C), azote (N), oxygène (O). Ils représentent un peu moins de 1,5% de la matière présente dans l’Univers. C’est l’oxygène qui est le plus abondant (0,84%). Le carbone vient derrière avec 0,34% et l’azote avec 0,12%. Le magnésium (Mg), le silicium (Si), le soufre (S) et le fer (Fe) sont les minéraux les plus abondants mais à eux quatre ils ne représentent pas plus de 0,25% de la matière ordinaire (0,12% pour le fer et 0,07% pour le silicium). Le néon (Ne) est un peu plus abondant mais il ne joue pratiquement aucun rôle en chimie organique.
Tous ces éléments (C, N, O, Mg, Si, S, F, Ne) sont issus de la nucléosynthèse stellaire. Les autres éléments chimiques présents dans l’Univers (également issus de la nucléosynthèse stellaire) sont beaucoup moins abondants. Ils peuvent néanmoins intervenir de manière décisive dans la chimie du vivant, comme c’est le cas pour le calcium et le phosphore.
Eléments chimiques et valence
Nous avons présenté plus en détail la liaison covalente dans le post précédent. Elle est basée sur la mise en commun d’électrons par deux atomes. Cette mise en commun permet une « économie d’énergie ». L’énergie économisée est appelée énergie de liaison. L’énergie de liaison est l’énergie qu’il faudrait fournir à la molécule ainsi constituée pour libérer les atomes qui la composent.
Tous les éléments chimiques sont caractérisés par leur valence. La valence d’un atome est son aptitude à accepter une ou plusieurs liaisons covalentes. Certains atomes sont réfractaires à toute liaison covalente. Ils ont une valence nulle. C’est le cas par exemple de l’hélium. Autant dire que malgré sa relative abondance dans l’Univers il n’est d’aucune utilité pour la chimie du vivant.
Hydrogène
Symbole : H, numéro atomique : 1
L’hydrogène est l’élément le plus simple qui puisses exister : un proton, un électron. Ce n’est pas tout à fait vrai : on peut également le trouver sous la forme deutérium (un proton, un neutron et un électron) et tritium (un proton, deux neutrons et un électron) mais ces isotopes sont très rares.
C’est, de loin, l’élément le plus abondant dans l’Univers. Dans les nuages interstellaires et les nébuleuses il est surtout présent sous sa forme ionisée (H+) ou moléculaire (H2). C’est le carburant de base qui alimente les étoiles. Il constitue également la majeure partie des planètes gazeuses. Pour des raisons qui sont liées à leur processus de formation, il est beaucoup moins abondant dans les planètes telluriques.
L’hydrogène est monovalent : il ne peut avoir qu’une seule liaison covalente. C’est le cas par exemple dans la molécule dihydrogène H2 ou encore dans la molécule d’eau H2O. Il est donc impossible de construire une molécule complexe uniquement à partir de l’hydrogène. Ceci ne veut pas dire qu’il n’intervient pas dans la chimie du vivant. Au contraire : il est omniprésent. Il faut dire que c’est le bouche-trou idéal ! Il s’immisce partout… Son abondance dans l’univers fait d’ailleurs que les autres composants se trouvent rarement à l’état atomique au sein des nuages interstellaires ou dans les nébuleuses. On les y trouve souvent sous forme de composés hydrogénés : CH4 (méthane) pour le carbone, NH3 (ammoniac) pour l’azote, H2O (eau) pour l’oxygène.
Comme nous l’avons dit, l’hydrogène se trouve souvent sous la forme ionisée H+ (ou H3O+ lorsque celui-ci est dissous dans l’eau). C’est l’agent de base des réactions acide-base. Il existe également sous une forme ionisée négativement, H-, appelée hydrure. Dans ce cas, il est généralement associé à un métal : hydrure de sodium (NaH), hydrure de lithium (LiH)…
Oxygène
Symbole : O, numéro atomique : 8
L’oxygène est l’élément le plus abondant dans l’Univers après l’hydrogène et l’hélium. Il est présent dans les nuages interstellaires et les nébuleuses sous la forme O2 ou H2O. Il existe trois isotopes stables de l’oxygène : 16O, 17O, 18O. L’isotope le plus abondant est 16O.
L’oxygène est très présent sur Terre : il représente plus de 80% de la masse des océans (H2O), 45% de la croûte terrestre (sous forme d’oxydes et de silicates) et 23% de la masse de l’atmosphère (O2). On le trouve également sous la forme moléculaire O3 (ozone) dans la stratosphère. L’oxygène (ou plutôt le dioxygène O2) n’était pourtant pas présent dans l’atmosphère terrestre originelle. Il a été produit au cours du premier milliard d’années par photosynthèse, tout d’abord par les cyanobactéries puis par les algues et les végétaux.
L’oxygène est bivalent : il peut avoir deux liaisons covalentes simples comme c’est le cas dans la molécule H2O ou une liaison double comme dans la molécule CO2 (O=C=O). Mais il dispose également d’un doublet non liant ce qui lui permet de nouer une liaison covalente de coordination. Il a également un fort potentiel électronégatif ce qui en fait un point d’ancrage pour les liaisons hydrogène. (Pour tous les termes en caractères gras, se reporter au post sur les bases de la chimie.) Le caractère électronégatif de l’oxygène en fait un agent oxydant puissant. De fait, l’oxygène tout comme l’hydrogène s’invite dans de très nombreuses réactions chimiques.
Deux liaisons covalentes, c’est insuffisant pour construire une chaîne moléculaire à base d’oxygène mais l’oxygène joue un rôle essentiel dans la chimie du vivant. Notre corps est composé à plus de 60% d’atomes d’oxygène ! Nous verrons plus tard que c’est un composant clef des acides aminés, mais également des sucres qui sont notre « carburant ».
Carbone
Symbole : C, numéro atomique : 6
En termes d’abondance dans l’Univers, le carbone vient juste après l’oxygène. Dans les nuages interstellaires et les nébuleuses il est surtout présent sous forme de méthane (CH4) et de dioxyde de carbone (CO2). Il existe trois isotopes naturels du carbone : 12C, 13C, 14C. L’isotope le plus abondant est 12C. Sur Terre, il n’occupe que le 15ème rang en abondance (charbon, oxydes de carbone, composés organiques et inorganiques).
Le carbone est tétravalent. Autrement dit, il peut s’associer simultanément à quatre autres atomes de valence non nulle. Les énergies de liaison correspondant à ces associations sont particulièrement intéressantes du point de vue de la chimie du vivant. Elles sont suffisantes pour assurer la stabilité des dérivés ainsi créés… et pas trop élevées pour permettre de multiples réactions chimiques entre ces dérivés. De fait, le carbone est à la base de chaînes dont la longueur défie l’entendement : l’ADN est une double chaîne en hélice comportant des dizaines de millions de molécules carbonées élémentaires ! Une chaîne carbonée comportant un ou plusieurs motifs porte le nom de polymère.
La chimie organique (propriétés chimiques et réactions des chaînes carbonées) est une branche à part entière de la chimie. Compte tenu de l’extrême diversité des composés organiques, on a été amené à introduire une classification tenant compte de leurs propriétés. Pour ne pas alourdir cet exposé, nous ne citerons que quatre types de composés organiques :
Un hydrocarbure est un composé organique ne comportant que des atomes de carbone et d’hydrogène. Exemple : le kérosène C10H22. Un hydrocarbure aromatique est un hydrocarbure comportant au moins un cycle benzénique (6 atomes de carbone formant une chaîne hexagonale).
Un alcool est un composé organique dont l’un des atomes de carbone est porteur d’un groupe hydroxyle (-OH). L’éthanol par exemple, CH3-CH2-OH, est l’alcool qui est à la base de nos boissons alcoolisées.
Un acide carboxylique est un composé organique comportant un groupe carboxyle (-COOH). Un groupe carboxyle est composé d’un atome de carbone lié à un atome d’oxygène par une double liaison et à un groupe hydroxyle (-OH) par une liaison simple. On appelle chaîne latérale la chaîne moléculaire à laquelle le groupe carboxyle est attaché. La base conjuguée des acides carboxyliques est appelée ion carboxylate. Comme nous l’avons vu dans le post précédent, l’ion carboxylate est hydrophile. Associé à une chaîne latérale apolaire, il forme un composé amphiphile. Les acides carboxyliques sont des constituants des acides aminés. Dans l’échelle de la complexité, on peut dire qu’ils sont un échelon intermédiaire entre les alcools et les acides aminés.
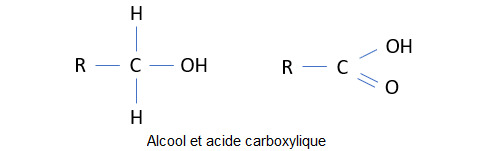
Un glucide est un composé organique comportant un groupe carbonyle (-C=O : un atome de carbone associé à un atome d’oxygène par une liaison double) et au moins deux groupes hydroxyles. Le glucose C6H12O6 est un glucide.
Azote
Symbole : N, numéro atomique : 7
C’est le 5ème élément le plus abondant dans l’Univers, juste après le carbone. Il possède beaucoup d’isotopes mais seul le 14N est stable. Dans les nuages interstellaires et les nébuleuses l’azote est surtout présent sous la forme ammoniac (NH3). Il représente les 4/5ème de l’atmosphère terrestre (N2) mais il est beaucoup moins abondant dans la croûte terrestre (principalement sous forme de nitrates). Les amines (molécules dérivées de l’ammoniac) sont des composants essentiels des acides aminés.
L’azote est trivalent. Il peut donc avoir trois liaisons chimiques. Cette trivalence permet à l’azote de participer à des molécules complexes en tant que maillon d’une chaîne tout en conservant une liaison disponible pour un autre atome ou groupe d’atomes. On parle dans ce cas de bases azotées. La guanine, l’adénine, la thymine, la cytosine et l’uracile sont des bases azotées. Elles jouent un rôle clef dans le codage des gènes de l’ADN et de l’ARN.

Nota : dans la représentation ci-dessus on a adopté une convention très répandue en chimie organique (on parle de formule topologique). Dans cette représentation, une liaison simple est figurée par un trait, une liaison double par deux traits. Les atomes de carbone ne sont pas représentés, ni les atomes d’hydrogène lorsqu’ils sont reliés par une liaison covalente à un atome de carbone. Les hétéroatomes et les atomes d’hydrogène qui leur sont reliés sont représentés par leur symbole. Dans le cas d’une famille de molécules différenciée par une chaîne latérale, celle-ci est représentée par la lettre R.
A priori, un atome trivalent peut constituer le maillon élémentaire d’une longue chaîne d’atomes. Dans la pratique, cela ne s’avère pas suffisant pour constituer une molécule aux fonctionnalités complexes. Si l’on prend l’exemple des acides aminés, c’est la présence d’un groupe carboxyle qui leur permet de jouer un rôle primordial en chimie organique.
L’azote est également à la base de nombreux composés : oxydes (ce que l’on appelle aujourd’hui les NOx : NO, NO2, N2O3…), halogénures d’azote (NF3, NCl3…), composés métalliques...
Remarque : il existe un cycle de l’azote comme il existe un cycle du carbone. La molécule diazote est en effet très présente dans l’atmosphère mais elle n’est pas directement assimilable par les cellules végétales et animales. L’azote atmosphérique ou l’azote dissous dans l’eau est d’abord fixé par des bactéries (ou des cyanobactéries) sous forme d’ammoniaque (NH4OH). D’autres bactéries transforment cet ammoniac en nitrite (NO2-) puis en nitrates (NO3-) . Les nitrates sont assimilables par les végétaux eux-mêmes consommés par les animaux. La décomposition des végétaux et des animaux morts produit également de l’ammoniaque. La boucle est bouclée grâce à d’autres bactéries qui « dénitrifient » les nitrates présents dans le sol et produisent du diazote.
Silicium
Symbole : Si, numéro atomique : 14
Dans l’Univers, le silicium est dix fois moins abondant que l’oxygène et cinq fois moins que le carbone. C’est néanmoins le deuxième élément le plus abondant de la croûte terrestre (un peu plus de 25% en masse) où il est présent sous forme de silicates (olivine et pyroxène). Il intervient comme d’autres éléments minéraux dans la chimie du vivant mais son rôle n’est pas essentiel. Alors pourquoi en parler ? Parce que le silicium est, comme le carbone, tétravalent. L’analogie va même plus loin : les silanes (SiH4, SinH2n+2) sont au silicium ce que le méthane et les hydrocarbures (alcanes) sont au carbone. On peut donc légitimement se poser la question de savoir s’il ne pourrait pas y avoir une chimie du vivant basée sur le silicium.
Le débat n’est pas tranché mais la plupart des scientifiques pensent que non. L’argument principal est le suivant : la chimie du vivant ne repose pas uniquement sur l’existence d’une infinie variété de molécules organiques. Le « cycle du carbone » joue aussi un rôle décisif : les cellules vivantes consomment de l’oxygène et rejettent du CO2 sous forme gazeuse, la photosynthèse absorbe ce CO2 et rejette de l’oxygène. Ce cycle n’a pas d’équivalent avec le silicium. Le SiO2 est pratiquement toujours à l’état solide et il est particulièrement stable !
Fer
Symbole : Fe, numéro atomique : 26
Le fer est le sixième élément le plus abondant dans l’Univers. C’est aussi, avec l’oxygène, l’un des éléments les plus abondants sur Terre : s’il ne représente que 5% de la masse de la croûte terrestre (sous forme d’alliage fer-nickel ou d’oxydes de fer), il constitue probablement plus de 80% de la masse du noyau ! Il possède de nombreux isotopes dont seuls quatre sont stables. L’isotope 56Fe est le plus abondant.
Tout comme le silicium, le fer intervient dans la chimie du vivant à titre de composant de sels minéraux (les oligoéléments, des sels qui sont indispensables, à dose très faible, à la vie d’un organisme). Si nous le mentionnons ici, ce n’est pas à ce titre mais parce qu’il joue un rôle clef dans les cycles marins (recyclage d’éléments comme le carbone, l’oxygène, le phosphore…).
Calcium
Symbole : Ca, numéro atomique : 20
Le calcium est le cinquième élément le plus abondant de la croûte terrestre (3% en masse). Il est surtout présent sous forme de carbonate de calcium (CaCO3), le composant de base des roches calcaires. Il joue un rôle essentiel dans la chimie des organismes vivants évolués (squelette, coquilles).
Il a également joué un rôle décisif dans l’élimination du CO2 de l’atmosphère. Les pluies acides (acidifiées par le CO2) ont en effet entraîné celui-ci dans les rivières et dans les océans. Il s’y est combiné avec le calcium pour former du carbonate de calcium qui s’est déposé sous forme de sédiment au fond des océans.
Phosphore
Symbole : P, numéro atomique : 15
Le phosphore est beaucoup moins abondant que les éléments que nous avons présentés ci-dessus. Il ne représente que 0,1% de la masse de la croûte terrestre. Si nous le mentionnons ici, c’est parce qu’il joue un rôle essentiel dans la chimie du vivant. Les groupes phosphate (dérivés de l’acide phosphorique) sont des éléments constitutifs des nucléotides (composants des acides nucléiques). Le phosphore intervient également dans la photosynthèse : la rubisco (ribbulose-1.5-biphosphate) permet de fixer le CO2 et la paire ADP/ATP (adénosine diphosphate/adénosine triphosphate) intervient dans le cycle de captation de la lumière puis de production des glucides. On retrouve ensuite cette même paire ADP/ATP dans le métabolisme des cellules.
Le phosphore est trivalent, comme l’azote. La chimie du phosphore est très riche.
Et les autres éléments ?
Le tableau de Mendeleïev comporte bien d’autres éléments… Parmi ceux-ci beaucoup interviennent à titre d’oligoéléments dans la chimie du vivant. Si nous ne les citons pas, c’est qu’ils ne jouent pas un rôle essentiel en tant qu’éléments constitutifs des molécules organiques. Il existe par exemple d’autres éléments tétravalents (le germanium, l’étain, le plomb…) et même des éléments de valence supérieure (le bismuth, le tellure…) mais ils sont beaucoup plus rares dans l’Univers ou sur Terre. Or, comme nous l’avons souligné en début de ce post, l’abondance des éléments est un facteur décisif dans la probabilité d’émergence de cellules vivantes.
Nous nous sommes intéressés aux principaux éléments chimiques intervenant dans les molécules organiques. La plupart du temps, ces éléments sont présents sous une forme composée dans l’Univers : eau, méthane, ammoniac, dioxyde de carbone. Nous allons présenter rapidement les principales propriétés de ces composés.
L’eau (H20)
Symbole : H20
Pour la plupart de biologistes, l’eau est tout aussi indispensable à la vie que le carbone. La molécule H2O est très abondante dans l’Univers. La formation de cette molécule à partir de l’hydrogène et de l’oxygène est en effet une réaction fortement exothermique qui peut se produire à peu près dans toutes les circonstances, y compris dans un nuage interstellaire.
La phase liquide de l’eau couvre une gamme de température relativement large (de 0 à 100 degrés sous une atmosphère) ce qui permet à l’eau de se maintenir dans cet état en dépit de variations de température de grande amplitude. En outre, la glace d’eau est moins dense que l’eau liquide. De ce fait, lorsqu’une étendue d’eau commence à geler, la glace reste en surface et isole l’eau en profondeur du froid extérieur. Un lac gelé ou une rivière gelée ne le sont qu’en surface. L’eau reste liquide en dessous d’une couche de glace d’épaisseur variable, ce qui permet à la vie de s’y maintenir. Si la glace était plus dense que l’eau liquide, la glace coulerait et l’étendue d’eau considérée pourrait geler en totalité. Toute forme de vie disparaitrait. Cette propriété de l’eau est liée aux liaisons hydrogène existant entre les molécules H2O à l’état liquide (voir le post sur les bases de la chimie).
L’eau présente un moment dipolaire non nul. La liaison entre l’atome d’oxygène et les deux atomes d’hydrogène de la molécule H2O est certes une liaison covalente, on pourrait donc s’attendre à ce que cette molécule soit apolaire. Mais en fait, l’atome d’oxygène a un fort potentiel électronégatif. La fonction d’onde des deux électrons covalents a plutôt tendance à se concentrer autour de celui-ci. Tout se passe comme si l’atome d’oxygène avait une charge négative 2ke- et chaque atome d’hydrogène une charge positive -ke- (avec k < 1, e- étant la charge électrique de l’électron). La molécule d’eau porte donc un moment dipolaire qui lui permet d’attirer des ions positifs côté atome d’oxygène ou des ions négatifs côté atomes d’hydrogène.
Cette particularité fait de l’eau un excellent solvant pour les composés qui sont aussi polarisés. Supposons par exemple que l’on plonge dans l’eau du chlorure d’hydrogène HCl. La liaison H-CL est une liaison covalente polarisée. Dans l’eau, les ions H+ et Cl- se séparent. L’ion H+ est attiré par le pôle négatif O-2k des molécules d’eau et forme avec ces molécules un composé appelé hydronium :

Ce processus porte le nom barbare de solvatation. C’est une caractéristique essentielle de l’eau. Elle permet à toutes les molécules organiques polaires de se dissoudre dans l’eau (on dit de ces molécules qu’elles sont hydrophiles) alors que les molécules apolaires ne sont pas dissoutes (molécules hydrophobes).
Comme nous le verrons dans le post suivant, certaines molécules organiques sont composées d’un groupe hydrophile et d’une chaîne latérale hydrophobe. On dit qu’elles sont amphiphiles. Les molécules amphiphiles ont des propriétés tensioactives (voir le post sur les bases de la chimie). Un agent tensioactif favorise la formation de surfaces de séparation entre deux liquides non miscibles. Lorsque cette surface se referme sur elle-même, il se forme une « goutte » au sein du solvant.
L’ion hydronium existe à l’état naturel dans l’eau. Il est produit par autoprotolyse :

L’ion OH- est appelé hydroxyde. Dans l’eau « pure », il y a équilibre entre les concentrations de ces deux ions. Leur concentration (le nombre de moles par litre) est caractérisé par un nombre appelé pH (échelle logarithmique). Le pH de l’eau pure est égal à 7. En présence d’acide, l’équilibre est rompu. Il y a plus d’ions hydronium que d’ions hydroxyde et le pH est inférieur à 7. En présence d’une base, c’est le contraire et le pH est supérieur à 7.
L’ammoniac
Symbole : NH3
L’ammoniac est également très présent dans les nuages interstellaires et les nébuleuses.
L’ammoniac présente des analogies avec l’eau : c’est un solvant ionisant et c’est un ligand. Il se prête aux liaisons hydrogène. Le couple NH4+ (ammonium) NH2- (amidure) peut être comparé au couple hydronium – hydroxyle. Dès lors, peut-on imaginer une chimie du vivant basée sur le carbone et l’ammoniac à l’état liquide ? C’est peu probable. La gamme de température dans laquelle l’ammoniac reste à l’état liquide est beaucoup moins étendue que celle de l’eau et par ailleurs, à pression égale, sa température d’évaporation est beaucoup plus basse (température de fusion : -77,7°C ; température d’évaporation : -33°C). Les réactions seraient donc beaucoup plus lentes, ce qui paraît peu compatible avec les besoins d’un organisme vivant. C’est la raison pour laquelle les astronomes et les exobiologistes recherchent plutôt des traces de vie sur la base du couple chimie du carbone-présence d’eau liquide.
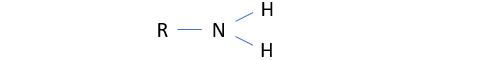
Par contre, la trivalence de l’azote fait de l’ammoniac un composé ayant de nombreux dérivés : les amines (R-NH2). Une amine est un dérivé de l’ammoniac dont au moins une des atomes d’hydrogène est remplacé par un groupe carboné. Les amines jouent un rôle essentiel en chimie organique (acides aminés).
Le méthane
Symbole : CH4
Le méthane, tout comme l’eau et l’ammoniac, est abondant dans les nuages interstellaires et les nébuleuses. Mais l’analogie avec l’eau et l’ammoniac s’arrête là. Le méthane est un piètre solvant : il ne dissout que les molécules légères. Sa température de fusion est encore plus basse que celle de l’azote, -182°C. Sa température d’ébullition est de -161°C.
Par ailleurs, le méthane est un réducteur puissant. En particulier, il réduit l’hématite pour donner de l’eau et du dioxyde de carbone :
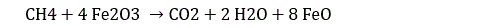
Voilà qui est contrariant. A priori, la molécule de méthane est indispensable à l’apparition des premières molécules organiques. La façon la plus simple de construire progressivement les différentes molécules organiques consiste chaîner des molécules de méthane entre elles et à remplacer l’un ou les deux atomes d’hydrogène restant par d’autres groupes d’atomes. Or l’hématite est omniprésente dans la croûte terrestre (en combinaison avec l’olivine). Cela signifie que le méthane n’a pas pu se maintenir longtemps dans l’atmosphère terrestre après la formation de la Terre !
Les scientifiques supposent cependant (fossiles à l’appui) que la concentration en méthane a recommencé à croître il y a 3,7 milliards d’années du fait de l’activité de microorganismes unicellulaires méthanogènes (voir le post sur le dioxyde de carbone). Ces microorganismes sont très rudimentaires, ils sont très voisins des bactéries (avec lesquelles ils ont été longtemps confondus).
Le dioxyde de carbone
Symboles : CO2
Nota : pour une présentation plus détaillée de la chimie du CO2, on peut se reporter au post consacré au dioxyde de carbone.
Le dioxyde de carbone (gaz carbonique) existe comme tel dans l’Univers mais, sur les planètes telluriques, il peut aussi provenir de l’oxydation du méthane (voir plus haut). Celle-ci peut survenir rapidement et on estime que, peu de temps après la formation de la Terre, l’atmosphère était composée principalement de CO2. Comment est-on passé d’une atmosphère saturée de CO2 à l’air que nous respirons dans lequel le CO2 ne représente qu’une partie infime ?
Il semble que nous devions ce miracle aux « pluies acides ». Le CO2 se dissout très facilement dans l’eau pour donner de l’acide carbonique :

Dans l’eau, l’acide carbonique se dissocie pour donner des ions carbonates (CO3--) et bicarbonates (HCO3-) :
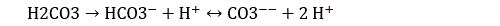
(L’ion H+ étant à son tour solvaté en ion hydronium.) Le CO2 étant un puissant gaz à effet de serre, les précipitations sont nombreuses au cours des premières centaines de millions d’années. L’eau acidifiée ruisselle dans les rivières ou tombe directement dans les océans. Au cours de ce ruissellement, l’acide carbonique réagit avec les silicates, et en particulier avec le CaSiO3 :
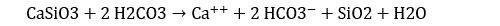
(Du CO2 est également dissous dans les océans par simple échange en surface.) Dans l’océan, l’ion carbonate précipite avec les ions calcium pour donner du carbonate de calcium :

Le carbonate de calcium sédimente au fond des océans sous forme de calcaire. Ces sédiments calcaires peuvent être entraînés sous la croûte terrestre par les phénomènes de subduction… ou former des massifs émergés et des falaises lorsque la plaque tectonique sur laquelle ils se sont déposés est soulevé au-dessus du niveau des océans.
Ce processus de « séquestration du CO2 » a agi seul pendant des centaines de millions d’années. Puis, il y a 3,7 milliards d’années, des microorganismes méthanogènes sont apparus. (Ce sont les fossiles les plus anciens d’organismes vivants que les géologues aient trouvés.) Le métabolisme de ces microorganismes est basé sur la réduction du CO2 par l’hydrogène :

Il y a 2,5 milliards d’années, l’apparition des oxyphotobactéries (une catégorie spécifique de cyanobactéries) a profondément modifié la composition de l’atmosphère terrestre. Les oxyphotobactéries sont adeptes de la photosynthèse. La photosynthèse est un processus chimique complexe qui absorbe du CO2 et libère de l’oxygène. On trouve des traces fossiles de cette activité photosynthétique sous la forme de stromatolithes, une structure calcaire qui se développe dans des fonds marins peu profonds ou dans des nappes d’eau douce.
L’activité de ces cyanobactéries a amplifié la fixation du carbone et a surtout commencé à alimenter l’atmosphère en dioxygène. L’oxygénation de l’atmosphère a conduit à la disparition de nombreux microorganismes méthanogènes qui sont strictement anaérobies. La teneur de l’atmosphère en méthane a alors recommencé à décroître avant de se stabiliser à un niveau proche de celui que nous connaissons.
Le cycle du carbone est aujourd’hui plus complexe. L’activité des cyanobactéries est devenue marginale et la photosynthèse végétale a pris le relais. L’océan continue de stocker du carbone mais une partie du carbonate de calcium finit sous forme de coquilles ou de squelettes (avant de sédimenter à la mort des animaux marins). Nouveauté par rapport au processus originel : la respiration animale produit du CO2. Le volcanisme en produit également mais sa contribution est marginale. Signalons enfin l’impact déstabilisant de l’activité humaine. La déforestation d’une part, qui réduit l’effet de la photosynthèse, et les rejets industriels qui, s’ils sont loin d’atteindre le niveau de production de CO2 de la respiration animale, introduisent un facteur de déséquilibre supplémentaire dans ce cycle qui a mis des centaines de millions d’années à se stabiliser.
Pour en savoir plus :
post sur les liaisons chimiques, les acides et les bases
post sur la formation de la Terre
post sur le dioxyde de carbone
post sur la classification périodique des éléments
post sur l’abondance des éléments dans le corps humain
glossaire de chimie organique
glossaire de chimie générale
index
#chimie#biochimie#archée#hydrogène#oxygène#carbone#azote#calcium#fer#phosphore#carboxyle#carboxylate#carbonyle#alcool#hydroxile#hydronium#ammoniac#méthane#oxyde de carbone#stromatolithe#cyanobactérie#solvatation#silicate#silicium#hdchimie
1 note
·
View note
Text
Dianabol
Dianabol is one
of the most commonly used oral steroids . Its chemical name is Methandrostenolone or Methanedienone, 17-alpha-methyl-17beta-hydroxil-androsta- l.4dien-3-on. There are many pharmaceutical and generic variations of the drug, including Anabol and Naposim. It is a steroid for oral use. It was widely used in the 1970s and is still used today for its rapid and intense gains in muscle volume. More information here
Its use stimulates the synthesis of protein in the muscles in a very intense way. It makes nitrogen and calcium show a positive balance. Increases calcium deposit in bones. Produces a feeling of well-being.
Dianabol can be used therapeutically in cases where an anabolic and general strengthening effect is needed as a result. It has been successful in combating osteoporosis.
It is commonly used by weight lifters and bodybuilders to increase their muscle mass and strength, it can be gained between 1 and 2 kilograms per week, during a period of six weeks, after the eighth it stops
producing gains, there are those who in week 6 or 7 add an injectable like
Decadurabolin for another six weeks to continue the gains.
Despite the fact that Dianabol has many potential side effects, these are rare at doses close to 20 mg / day.
Dianabol has a life time of 3.2 to 4.5 hours in blood, therefore it is necessary to ingest it at least 2 times a day to achieve some type of concentration of the substance in the blood. On days of intense training it is convenient to use 3 daily doses. Its consumption with meals is recommended. When ingested, the maximum concentration in blood is reached after 1 to 3 hours.
It produces a decrease in endogenous cortisone by 50 to 70%, which is favorable for increasing muscle mass, since corticosteroid hormones have a catabolic effect.
In addition, Dianabol produces an intense increase in the concentration of testosterone in blood in men and does not suppress the natural axis, it only
inhibits it depending on the dose.
In general it gives a feeling of well-being and high self-esteem, improves appetite and can improve mood.
On the third day after stopping Dianabol use, the blood test for the substance is negative, but the use of steroid substances can be detected by other methods. SEE ANABOLIZING CYCLES Clinical Use of Dianabol Dianabol has been shown to increase anaerobic glycolysis, leading to an increase in body-produced lactic acid. This is positive,
since the muscles use lactic acid to create glycogen, which in
turn provides energy for anaerobic metabolism. Lactic acid is also a key chemical for the elimination of carbohydrates from the diet, which means that there is less chance of gaining weight while using Dianabol.
A study on osteoporosis showed that, at a dose of only 2.5 mg daily for 9 months, Dianabol was more effective than calcium supplements in reducing osteoporotic activity, and it was also shown to increase muscle mass more effective. Another study on osteoporosis, lasting 24 months, showed the effect of Dianabol on osteoporosis; This increased the total calcium and potassium in the body. This may not be of interest to bodybuilders, but the action of calcium is very important for bodybuilding, as it carries a large amount of amino acids and creatine, which are essential for muscle growth. Potassium is also very important, since it helps in cases of muscle contraction, in the transmission of nerve signals and in the release of insulin; thus,
Another very interesting study, although not very significant in terms of bodybuilding, showed that Dianabol increases the sensitivity of laryngeal tumor cells to radiotherapy, and concluded "recommending the use of this hormone during radiotherapy processes in patients with laryngeal cancer." Flavoring Flavoring frequently occurs with Dianabol, that is, it transforms into estrogens, so using Nolvadex is very important while using this product. It also produces fluid retention as a consequence of aromatization and probably changes in the mineral mineral balance, so we must control blood pressure and have a diuretic on hand in case it is necessary. Liver toxicity of dianabol
Being an Alpha Alkylated C 17 compound, it is quite toxic to the liver,
so adding Silymarin is essential and at the same time not prolong its use for
more than 6 - 7 weeks. At high dosages and for longer periods of time, Dianabol (Anabolex) is toxic to the liver, even a dosage of only 10 mg / day can increase liver values, however, after discontinuation of the drug, the values return to The normality. A study in rats showed that, regardless of the dose or the time of administration, Dianabol produces changes in enzyme activity leading to hypertrophy of hepatocytes, showing the toxicity of Dianabol to the liver.
However, in another study it was found that Nerobol (the Russian equivalent of Dianabol) favors the rapid normalization of functional and metabolic disturbances of the liver, which is contradicted by previous tests. This shows that the idea that Dianabol is dangerous is not as negative as some might think. Dosage The dose can vary between 15 and 20 mg. for beginners - intermediate and between 20 - 40 mg. per day for advanced athletes, although there are athletes that reach even 50 mg. From 30 mg. Side effects can be aggravated and roast 40-50 mg. it is simply to increase the side effects without any benefit. Women cannot take this drug. How to cycle Dianabol
To create a cycle for Dianabol based on more use as a supplement than a steroid, we must first take into account the current trend to cycle Dianabol and analyze its possible negative aspects. An average Dianabol cycle is typically structured with 20-40 mg divisions each day for 4-6 weeks, both alone and in combinations with other steroids.
First, a dose of 25 mg or more frequently results in fluid retention. Dianabol is known to aromatize easily, and most of the fluid retention is often attributed to excess estrogen production. However, I consider that fluid retention originally occurs because the body clings to water due to Dianabol's effects on the body's mineral balance, especially on the potassium / sodium balance. This, coupled with the fact that Dianabol produces estrogenic side effects, leads to considerable fluid retention; Since we can't do much about changes in the body's mineral balance, all we can do is try to reduce aromatization, usually with Nolvadex (tamoxifen) or other antiestrogens.
However, this is not the only method: by reducing the dose, the drug will aromatize less, which will lead to less estrogen and, especially, less fluid retention. Reducing the drug during a cycle would lead to a slow reduction in estrogen levels, so we should start the cycle with a lower dose of 10-20 mg every day.
Dividing the dose when following a low dose is practically useless, as a much lower maximum drug level will be obtained. Therefore, in this case it is better to take a single dose in the morning (preferably with grapefruit juice). Although this will not prevent the suppression of natural testosterone, it can reduce it to a certain extent, as the body will continue to have long periods at the end of the day with little testosterone circulation, so it is possible that it produces some.
Now if we take a look at the cycle length 4-6 weeks seems too short to have real effects at such a low dose but can we use Dianabol longer without putting our liver in more danger?
The solution is quite simple: when we stop taking the drug on weekends, we will give the liver a break, without having to process the drug. Due to its short half-life, any active substance will be out of the body in 24 hours from the last dose; It may seem that it will make you earn less, but in reality it will hardly mean long-term losses, since although the body does not have an active drug, its effects are still present, for example, in extra intramuscular fluid, and a greater anabolic mineral balance.
These effects usually diminish for several days. However, this method will not encourage the body's natural testosterone to come out of its inhibited state, as this process may take much longer. If we take a lower dose and rest from it on weekends, in theory we should be able to use Dianabol for 10 weeks without problem. A little math can more clearly show this idea:
6 weeks at 25mg daily = 1050mg Dianabol total
10 weeks break on weekends at 15mg every day = 750mg Dianabol total
Thus, as can be seen, following this system allows the liver to process less Dianabol than in a normal cycle, in addition to the fact that it can obtain benefits for 10 weeks instead of 6, with fewer side effects and obtaining a cycle solid.
This cycle theory can be applied in countless situations, eg a beginner can only use Dianabol for 10 weeks and get very good results. A more experienced steroid user could use it in conjunction with an injectable cycle to get very good results, getting the initial quick benefits of Dianabol and the slower but stronger benefits of the injectable. There are also athletes who use it as a bridge, (rest time between
cycles) that is, after the post cycle or before starting a new one. In this
case 10 mg would be taken. when we get up at the first meal.
This technique can be effective for maintaining muscles, but dangerous for our liver.
It may seem that this cycle goes against the most common trends in the use of Dianabol, but using it as a supplement to good training and nutrition, it can achieve very positive results.
1 note
·
View note
Video
tumblr
Wenn eine häufige Händedesinfektion erforderlich ist, kann die wiederholte Verwendung eines alkoholhaltigen Händedesinfektionsmittels die Haut reizen und ihr die natürlichen Schutzöle entziehen, die für eine gesunde Hautpflege erforderlich sind. Dadurch bilden sich kleine Risse in der Haut, in denen sich Bakterien und Keime ansammeln, was wiederum zu Pilzwachstum und bei größeren Hautrissen zu Blutungen führen kann.
Das alkoholfreie Desinfektionsmittel HYDROXIL wurde von Dermatest fachärztlich dermatologisch an Menschen geprüft und bestand die Prüfung am 14.04.2020 mit Note „sehr gut“. Es traten im offenen Epikutantest nach internationalen Richtlinien keine toxisch-irritativen Unverträglichkeitsreaktionen oder Sensibilisierungen bei den Testpersonen auf. Das Produkt kann deshalb mit dermatologisch getestet deklariert werden.
#desinfektion #desinfektionsmittel #hygiene #hygienetips #hygieneproducts #händedesinfektion #händedesinfektionsmittel #covid #covid_19 #corona #coronavid19 #prpmed
0 notes
Text
Chimie du vivant : émergence des molécules qui constituent les cellules vivantes
La chimie du vivant est un sujet passionnant. Et tout aussi passionnante est la quête des origines de la chimie du vivant. Nous sommes tous composés des mêmes atomes : du carbone, de l’azote, de l’oxygène, de l’hydrogène, une pincée de minéraux divers… Tous ces éléments, à l’exception de l’hydrogène issu directement du Big-bang, ont été forgés dans de lointaines étoiles et se sont dispersés lorsque celles-ci ont explosé (voir le post sur la nucléosynthèse). Ces matériaux sont ensuite recyclés dans de nouvelles étoiles. Lors de la formation de ces nouvelles étoiles, des grains de matière laissés pour compte par celles-ci s’agglutinent pour former des planètes (voir le post sur la formation du système solaire). Et parmi ces grains de matière se trouvent les atomes dont nous sommes formés. Pour citer la formule de Carl Sagan reprise par Hubert Reeves, nous sommes tous des poussières d’étoiles.
Nous avons rappelé dans les posts précédents quelques principes de base de la chimie ainsi que les propriétés principales des éléments qui constituent les molécules organiques. Assez de chimie… Passons à la chimie du vivant. La biochimie est la branche de la chimie qui s’intéresse aux réactions qui conduisent à la constitution des cellules et à leur fonctionnement.
De manière schématique, on peut dire que la chimie du vivant est basée sur deux types de molécules complexes : les acides nucléiques (ARN, ADN) et les protéines. Mais comment est-on passé du quadruplet C-H-O-N, ou disons du triplet CH4-NH3-H2O à une molécule comme l’ADN qui composte des dizaines de millions de maillons élémentaires ? C’est une question qui taraude les biochimistes depuis des décennies. Pas de scoop : ils n’ont pas encore trouvé LA solution, ou disons plutôt LE scenario qui permettrait de décrire toutes les étapes d’un processus qui s’est déroulé sur des centaines de millions, voire des milliards d’années. Ils ont cependant réussi à assembler quelques pièces du puzzle que nous présenterons un peu plus loin dans ce post. Dans un premier temps nous donnerons quelques détails sur la composition et les propriétés des composés élémentaires des acides nucléiques et de protéines.
Eléments de base et macromolécules
La vie requiert l’existence de macromolécules très complexes. L’ADN, l’acide désoxyribonucléique, est un polymère en double hélice qui comporte des dizaines de millions de molécules de base. C‘est un acide nucléique, tout comme l’ARN. Les acides nucléiques sont composés d’une chaîne de nucléotides. Un nucléotide est constitué d’une base azotée, d’un sucre à cinq atomes de carbone (pentose) et d’un ou plusieurs groupes phosphate. Les protéines, également indispensables à la vie, résultent d’un assemblage complexe de macromolécules (les polypeptides) elles-mêmes composées de dix à cent acides aminés.
Acides nucléiques et protéines sont des polymères. Un polymère est une molécule constituée de la répétition de molécules complexes plus simples (les monomères) reliées entre elles par une liaison covalente. Ces monomères sont :
les acides aminés (il en existe une vingtaine de types),
les bases azotées (5),
des sucres (les pentoses),
des groupes phosphate.
Tous ces monomères sont composés à partdes mêmes éléments de base : l’hydrogène (H), le carbone (C), l’azote (N) et l’oxygène (O). Pas de surprise : ce sont les éléments les plus abondants dans l’Univers (l’hélium ne peut s’associer à aucun autre élément). C’est le carbone qui forme la colonne vertébrale de toutes ces macromolécules. Les explications (très schématiques) que nous avons données dans les posts précédents (post sur les bases de la chimie et les composants élémentaires) aident à mieux comprendre le rôle clef du carbone et l’extraordinaire diversité des combinaisons qu’il permet.
Si l’on excepte l’hydrogène, ces éléments se rencontrent rarement à l’état atomique dans le milieu interstellaire. On les trouve plutôt sous forme moléculaire : CH4 (méthane), H2O (eau), NH3 (ammoniac) ou HCN (cyanure d’hydrogène). Ces molécules se forment naturellement au gré des rencontres entre atomes dans les nuages interstellaires ou dans les nébuleuses issues de l’explosion d’une étoile en fin de vie.
Acides aminés, bases azotées et sucres
Tout d’abord, quelques définitions…
Les acides aminés sont des molécules organiques (des chaînes carbonées) qui comportent une terminaison de type acide carboxylique (O=C-OH) et au moins un groupe amine (C-NH2). Dans un groupe amine, l’azote étant trivalent, toutes ses liaisons sont occupées. Il en reste par contre deux de libres pour le carbone, ce qui permet à ce type de groupe de s’insérer au sein d’une chaîne carbonée. On a identifié plus d’une centaine d’acides aminés mais seule une vingtaine d’entre eux jouent un rôle dans la chimie du vivant. Ce sont les maillons de base des protéines.

Au sein d’un polypeptide, les acides aminés sont chaînés les uns avec les autres par une liaison peptidique. Une liaison peptidique est une liaison covalente entre le groupe carboxyle d’un acide aminé et le groupe amine d’un autre acide aminé.
Une base azotée est une molécule maillée dont certains nœuds sont constitués par des atomes d’azote. Comme son nom l’indique, ce type de molécule est une base au sens chimique du terme. Seules cinq base azotées interviennent dans la chimie du vivant : la guanine, l’adénine, la thymine, la cytosine et l’uracile. Leur rôle est essentiel : ces molécules sont à la base du codage des acides nucléiques (ADN et ARN).

Les bases azotées peuvent s’apparier entre elles par le biais de deux liaisons hydrogène (les atomes d’azote dispose d’un doublet non liant). C’est cet appariement qui explique la structure en double hélice de l’ADN.
Les glucides sont des chaînes carbonées (autrefois appelées hydrates de carbone) qui comportent une terminaison C=O (carbonyle) ainsi que plusieurs groupes C-OH (également appelés groupes hydroxiles). Une terminaison carbonyle est caractérisée par une double liaison covalente entre un atome de carbone et un atome d’oxygène.

Un phosphate est un sel minéral résultant de la réaction entre une base et de l’acide phosphorique H3PO4.
Comment se forment les monomères ?
Cette question s’est posée aux biologistes dès que leur rôle a été identifié. Les chimistes Stanley Miller et Harold Urey ont cru avoir trouvé la solution dès 1952. Ils ont porté à ébullition de l’eau dans une enceinte fermée contenant du méthane et de l’ammoniac et ont soumis ce dispositif à d’incessantes décharges électriques pendant des semaines. A l’issue de cette expérience, de nombreux acides aminés s’étaient formés. L’expérience a fait grand bruit et suscité beaucoup d’enthousiasme.
L’enthousiasme est retombé… A mesure que les astrophysiciens progressaient dans leur compréhension du processus de formation de la Terre, il est apparu de plus en plus clairement que le méthane et l’ammoniac n’avaient pas pu se maintenir longtemps dans l’atmosphère. L’ammoniac, soumis aux ultraviolets du Soleil (il n’y avait as d’oxygène dans l’atmosphère, donc pas d’ozone dans la stratosphère pour bloquer les UV), s’est rapidement dissocié pour laisser la place à l’azote moléculaire N2. Quand au méthane, dans la fournaise de la jeune Terre et en présence de poussières ou de dépôts d’oxyde de fer, il s’est rapidement oxydé pour donner du dioxyde de carbone (CO2) :

(La réduction de l’hématite et de la magnétite aux alentours de 800 degrés par le méthane est une réaction bien connue des métallurgistes.) L’atmosphère originellement riche en CH4 et NH3 s’est donc très rapidement dégradée en un mélange d’azote et de dioxyde de carbone.
Retour à la case départ… Deux autres pistes ont alors été analysées. La piste extra-terrestre et la piste océanique. La piste extra-terrestre : l’analyse spectrale du gaz interstellaire a en effet montré que des molécules prébiotiques (des composants des acides aminés) y sont présentes en abondance. Ce qui signifie que les réactions chimiques qui se produisent au sein de ces nuages ne se limitent pas à la production de CH4, NH3, H2O et HCN. Au gré des rencontres entre ces molécules, des chaînes plus complexes peuvent s’assembler. Miraculeux hasard ? Pas forcément si on tient compte du fait que ces nuages peuvent subsister des centaines de millions d’années avant de s’effondrer. L’analyse de la composition de la comète Tchouri par la sonde Rosetta a confirmé les résultats obtenus par spectroscopie. Celle-ci contient de nombreuses molécules prébiotiques (alcools, carbonyles, amines…). En particulier, le dispositif COSAC (cometary sampling and composition experiment) embarqué à bord de Philae a détecté 16 types de composés organiques, plusieurs composés azotés ainsi que de l’acide phosphorique. Les photos prises par le dispositif CIVA (comet infrared visible analyser) conduisent même à penser que ces molécules organiques sont agglomérées pour former de gros grains visibles à la surface de la comète ! Les scientifiques ont même identifié la présence de glycine dans la composition de Tchouri, un acide aminé relativement simple mais dont la présence n’avait à ce jour jamais été identifiée dans l’espace.
Une origine océanique ?
La piste océanique s’avère également très prometteuse. L’oxyde de fer en suspension dans l’eau entraine la production d’hydrogène :

Cette réaction se produit également avec les composés qui contiennent de l’oxyde de fer, comme l’olivine, très présente dans la croûte et le manteau terrestre. L’hydrogène libéré peut alors réagir avec le CO2 et le N2 dissous dans l’eau pour former du méthane et de l’ammoniac… qui peuvent à leur tour réagir entre eux pour synthétiser acides aminés et bases azotées.
Les scientifiques mettent également en avant l’activité méthanogène de certains microorganismes unicellulaires de la classe des archées, microorganismes qui peuvent se développer dans des milieux extrêmes (cheminées volcaniques, geysers…).
Ces deux pistes (extraterrestre et océanique) peuvent bien sûr coexister, la piste océanique bénéficiant de l’apport de molécules prébiotiques apportées par les comètes et astéroïdes.
Des monomères pré-biotiques aux macromolécules complexes
Il ne fait plus de doute pour les biochimistes que les briques élémentaires de la chimie du vivant que sont les acides aminés, les bases azotées et les sucres sont apparus très rapidement sur la Terre : soit directement au sein des océans, soit en bénéficiant de l’apport de molécules complexes apportées par les comètes lors des phases de bombardement primitif. La polymérisation de ces monomères est une autre paire de manches… surtout si l’on veut aboutir à des chaînes aussi longues que celles qui constituent les protéines ou les acides nucléiques. Cette fois, ce sont les géologues qui ont contribué à trouver la solution de ce problème. Ils ont montré que la jeune Terre était riche en argiles et en sulfures. Les sulfures ont des propriétés électriques qui leur permettent d’absorber les monomères prébiotiques. Les argiles sont constituées de milliards de feuillets d’une dizaine d’angströms d’épaisseur séparés par un intervalle de la même dimension. Certaines argiles, les smectites en particulier, peuvent absorber de l’eau entre ces feuillets (on parle d’adsorption lorsque l’eau s’immisce entre les feuillets). Les monomères dissous ou en suspension dans l’eau sont alors piégés. Ils peuvent se concentrer et réagir entre eux. Des expériences ont montré qu’ils polymérisaient beaucoup plus facilement dans ces conditions qu’en solution dans l’eau.
Nota : la terre de Sommières, qui est une smectite, est aujourd’hui couramment utilisée pour sa capacité d’absorption des molécules organiques, et en particulier des graisses.
L’argile et les sulfures ont la capacité de créer des polymères de très grande taille. Nous avons fait un bout du chemin qui mène des poussières d’étoiles aux organismes vivants mais nous sommes encore très loin du but !
Des molécules tensioactives
Comment définit-on un organisme vivant ? La définition est loin de faire l’unanimité. Je n’ai pas la prétention de présenter MA définition. Je me contenterai d’avancer quelques généralités :
un organisme vivant doit être capable de se reproduire,
un organisme vivant doit être capable de produire son énergie à partir de nutriments,
un organisme vivant doit être capable d’agir sur le milieu qui l’entoure,
un organisme vivant doit être capable de s’adapter aux variations des conditions ambiantes à court et à long terme.
Mais avant même de remplir toutes ces conditions, un organisme vivant doit disposer d’une enveloppe qui le sépare du milieu ambiant… tout en ne l’isolant pas totalement.
Cette condition peut sembler a priori difficile à réaliser. Elle résulte pourtant de propriétés relativement banales de certaines molécules organiques. Dès le début des années 1920, le biochimiste russe Alexandre Oparine a montré que certaines macromolécules organiques étaient des composés tensioactifs. Elles sont en effet amphiphiles, c’est à dire qu’elles sont composées d’au moins un groupe hydrophile et d’un groupe hydrophobe. Lorsque ces molécules sont présentes en quantité suffisante, elles ont tendance à se regrouper pour former une membrane (les molécules hydrophobes ne sont pas miscibles dans l’eau). Lorsqu’elle est refermée sur elle-même cette membrane isole en son sein une sorte de gouttelette, appelée coacervat, qui pourrait être l’embryon d’une cellule. Les expériences ont montré que des échanges pouvaient avoir lieu entre l’intérieur et l’extérieur de ces coacervats. Le biochimiste Sidney Fox a même réalisé des expériences au cours desquelles des coacervats qui avait grossi se subdivisaient en deux coacervats. Mais de là à parler de reproduction, il y a un très long chemin qu’aucun biochimiste sérieux n’a franchi. Cette subdivision ne produit pas nécessairement deux coacervats identiques !
Le mystère reste entier…
Comme on peut le voir, les éléments de réponse apportés par les scientifiques sont nombreux et bien étayés. Mais personne, à ce jour, n’a réussi à recréer une cellule vivante ab initio en laboratoire. Ce n’est au fond pas étonnant : les biochimistes travaillent sur ce sujet depuis un peu moins d’un siècle (les travaux d’Oparine datent des années 1920) alors que la nature a eu des centaines de millions d’années pour parvenir à ses fins.
Aujourd’hui, plusieurs scenarii sont proposés. Certains font naître la vie du fond des océans, en donnant un rôle majeur aux sources hydrothermales qui entraînent une forte concentration de molécules organiques très diverses. D’autres la font naître des océans mais à partir de hauts fonds dans lesquels la lumière du Soleil peut pénétrer. Un troisième scenario met en avant le rôle de « mares » qui s’assèchent et se remplissent régulièrement et sont réchauffées par des phénomènes volcaniques. Ceux qui défendent un tel scenario insiste sur le fait qu’il permet de décomposer le processus de création de macromolécules organiques complexes en étapes successives, ce qui facilite la montée en complexité. Tous partent de l’hypothèse que le bombardement de la Terre par des astéroïdes et des comètes a apporté une grande quantité de molécules prébiotiques, ce qui a permis à la vie de ne pas partir d’une page blanche.
Résumons ce que la science nous dit de l’histoire de la chimie du vivant :
Les molécules organiques sont composées très majoritairement d’hydrogène, de carbone, d’azote et d’oxygène. Ces quatre atomes font partie des cinq éléments les plus abondants dans l’Univers.
La chimie du vivant repose sur les propriétés chimiques exceptionnelles de ces quatre atomes, et en particulier sur celles du carbone, capable à lui seul de former l’ossature de macromolécules complexes comportant des millions de maillons élémentaires.
Non seulement ces atomes sont abondants dans l’Univers mais de plus le brassage au sein des nuages interstellaires et les phénomènes cataclysmiques qui se produisent lors de la fin de vie des étoiles conduisent à la formation de molécules plus complexes comme le méthane, l’eau, l’ammoniac, mais également de molécules prébiotiques (alcools, carbonyles, amines) dont on retrouve les traces dans les comètes et les nébuleuses.
Si l’atmosphère terrestre se montre peu propice à l’apparition de la vie immédiatement après la formation de la planète du fait d’une très forte concentration en CO2, un certain nombre de processus abiotiques (indépendants de l’existence d’organismes vivants) vont permettre une forte diminution de cette concentration.
L’apport de molécules prébiotiques par les comètes et les astéroïdes et les conditions régnant dans l’océan primordial vont alors conduire à l’apparition des premiers microorganismes vivants, en particulier des archées méthanogènes.
C’est probablement dans les argiles que la polymérisation nécessaire à la constitution des macromolécules à la base de ces microorganismes s’est produite. Les propriétés tensioactives de certaines de ces macromolécules leur ont permis de former des gouttelettes en suspension dans le milieu aqueux.
L’augmentation de la teneur en méthane de l’atmosphère et dans l’eau va favoriser la synthèse d’autres molécules organiques. Un milliard d’années plus tard, les cyanobactéries vont entrer en jeu. Ces cyanobactéries sont parmi les premières à mettre en œuvre la photosynthèse. La production d’hydrogène en masse va alors commencer.
L’oxygénation de l’atmosphère conduit à la disparition de beaucoup de ces microorganismes méthanogènes qui sont strictement anaérobies. La teneur de l’atmosphère en méthane recommence à décroître avant de se stabiliser. L’atmosphère est désormais principalement composée d’azote et d’oxygène. La vie telle que nous la connaissons s’organise. Le cycle du carbone y joue un rôle essentiel.
Sera-t-il possible demain d’écrire les pages qui manquent à ce scénario ? Sera-t-il possible de recréer en laboratoire un virus ? Une cellule ?
Pour en savoir plus :
post sur les liaisons chimiques, les acides et les bases
post sur le dioxyde de carbone
post sur les éléments chimiques et les gaz interstellaires
post sur l’abondance des éléments dans le corps humain
post sur la formation de la Terre
post sur les gènes et l’ADN
index
#chimie#biochimie#oparine#macromolécule#organique#chimie organique#coacervat#hydrogène#azote#oxygène#carbone#méthane#ammoniac#eau#photosynthèse#archée#tensioactif#adn#acide nucléique#protéine#peptide#nucléotide#acide aminé#base azotée#hdchimie
1 note
·
View note
Text
You mean hydroxilic acid?
Is water a chemical?
18 notes
·
View notes
Text
Dianabol
Dianabol ist einer
der am haufigsten verwendeten
orale Steroide. Sein chemischer Name ist Methandrostenolon oder Methandienon, 17-alpha-Methyl-17beta-hydroxil-androsta-l.4dien-3-on. Es gibt viele pharmazeutische und generische Variationen des Arzneimittels, einschlie?lich Anabol und Naposim. Es ist ein Steroid zur oralen Anwendung. Es war in den 1970er Jahren weit verbreitet und wird heute noch wegen seiner schnellen und intensiven Zunahme des Muskelvolumens verwendet.
Seine Verwendung stimuliert auf sehr intensive Weise die Proteinsynthese in den Muskeln. Dadurch zeigen Stickstoff und Kalzium ein positives Gleichgewicht. Erhoht die Kalziumablagerung in den Knochen. Erzeugt ein Gefuhl des Wohlbefindens Ausbildung.
Dianabol kann therapeutisch eingesetzt werden, wenn eine anabole und allgemeine Starkung erforderlich ist. Es war erfolgreich bei der Bekampfung von Osteoporose.
Es wird ublicherweise von Gewichthebern und Bodybuildern verwendet, um ihre Muskelmasse und Kraft zu steigern. Es kann zwischen 1 und 2 Kilogramm pro Woche wahrend eines Zeitraums von sechs Wochen nach dem achten Ende gewonnen werden
Es gibt diejenigen, die in Woche 6 oder 7 ein injizierbares wie hinzufugen
Decadurabolin fur weitere sechs Wochen, um die Gewinne fortzusetzen.
Trotz der Tatsache, dass Dianabol viele mogliche Nebenwirkungen hat, sind diese bei Dosen nahe 20 mg / Tag selten.
Dianabol hat eine Lebensdauer von 3,2 bis 4,5 Stunden im Blut, daher ist es notwendig, es mindestens zweimal taglich einzunehmen, um eine bestimmte Konzentration der Substanz im Blut zu erreichen. An Tagen intensiven Trainings ist es zweckma?ig, 3 tagliche Dosen zu verwenden. Der Verzehr zu den Mahlzeiten wird empfohlen. Bei Einnahme ist die maximale Konzentration im Blut nach 1 bis 3 Stunden erreicht.
Es bewirkt eine Abnahme des endogenen Cortisons um 50 bis 70%, was fur die Erhohung der Muskelmasse gunstig ist, da Corticosteroidhormone eine katabolische Wirkung haben.
Daruber hinaus fuhrt Dianabol bei Mannern zu einem starken Anstieg der Testosteronkonzentration im Blut und unterdruckt nicht nur die naturliche Achse
hemmt es je nach Dosis.
Im Allgemeinen vermittelt es ein Gefuhl des Wohlbefindens und des hohen Selbstwertgefuhls, verbessert den Appetit und kann die Stimmung verbessern.
Am dritten Tag nach Beendigung der Verwendung von Dianabol ist der Bluttest fur die Substanz negativ, die Verwendung von Steroidsubstanzen kann jedoch mit anderen Methoden nachgewiesen werden. SIEHE ANABOLISIERENDE ZYKLEN Klinisch Verwendung von Dianabol Dianabol Es wurde gezeigt, dass es die anaerobe Glykolyse erhoht, was zu einem Anstieg der im Korper produzierten Milchsaure fuhrt. Das ist positiv,
da die Muskeln Milchsaure verwenden, um Glykogen zu erzeugen, das in
wiederum liefert Energie fur den anaeroben Stoffwechsel. Milchsaure ist auch eine Schlusselchemikalie fur die Eliminierung von Kohlenhydraten aus der Nahrung, was bedeutet, dass die Wahrscheinlichkeit einer Gewichtszunahme bei der Anwendung von Dianabol geringer ist.
Eine Studie uber Osteoporose zeigte, dass Dianabol bei einer Dosis von nur 2,5 mg taglich uber 9 Monate bei der Verringerung der osteoporotischen Aktivitat wirksamer war als Kalziumpraparate, und es wurde auch gezeigt, dass es die Muskelmasse wirksamer erhoht. Eine weitere 24-monatige Studie zur Osteoporose zeigte die Wirkung von Dianabol auf die Osteoporose. Dies erhohte das gesamte Kalzium und Kalium im Korper. Dies mag fur Bodybuilder nicht von Interesse sein, aber die Wirkung von Kalzium ist fur das Bodybuilding sehr wichtig, da es eine gro?e Menge an Aminosauren und Kreatin enthalt, die fur das Muskelwachstum wesentlich sind. Kalium ist auch sehr wichtig, da es bei Muskelkontraktionen, bei der Ubertragung von Nervensignalen und bei der Freisetzung von Insulin hilft. somit,
Eine weitere sehr interessante Studie, die zwar im Hinblick auf das Bodybuilding nicht sehr signifikant ist, zeigte, dass Dianabol die Empfindlichkeit von Kehlkopf-Tumorzellen gegenuber Strahlentherapie erhoht, und kam zu dem Schluss "Empfehlung der Verwendung dieses Hormons wahrend Strahlentherapieprozessen bei Patienten mit Kehlkopfkrebs." Aroma Aroma tritt haufig bei Dianabol auf, dh es wandelt sich in Ostrogene um, daher ist die Verwendung von Nolvadex bei der Verwendung dieses Produkts sehr wichtig. Es fuhrt auch zu Flussigkeitsretention als Folge der Aromatisierung und wahrscheinlich zu Veranderungen des Mineralstoffhaushalts. Daher mussen wir den Blutdruck kontrollieren und ein Diuretikum zur Hand haben, falls dies erforderlich ist. Lebertoxizitat von Dianabol
Als alpha-alkylierte C 17 -Verbindung ist es fur die Leber ziemlich giftig.
Das Hinzufugen von Silymarin ist daher unerlasslich und verlangert gleichzeitig nicht die Verwendung fur
mehr als 6 - 7 Wochen. Bei hohen Dosierungen und fur langere Zeitraume ist Dianabol (Anabolex) fur die Leber toxisch. Selbst eine Dosierung von nur 10 mg / Tag kann die Leberwerte erhohen. Nach Absetzen des Arzneimittels kehren die Werte jedoch zur Normalitat zuruck . Eine Studie an Ratten zeigte, dass Dianabol unabhangig von der Dosis oder dem Zeitpunkt der Verabreichung Veranderungen der Enzymaktivitat hervorruft, die zu einer Hypertrophie der Hepatozyten fuhren, was die Toxizitat von Dianabol fur die Leber zeigt.
In einer anderen Studie wurde jedoch festgestellt, dass Nerobol (das russische Aquivalent von Dianabol) die rasche Normalisierung von Funktions- und Stoffwechselstorungen der Leber begunstigt, was durch fruhere Tests widerlegt wird. Dies zeigt, dass die Vorstellung, dass Dianabol gefahrlich ist, nicht so negativ ist, wie manche vielleicht denken. Dosierung Die Dosis kann zwischen 15 und 20 mg variieren. fur Anfanger - Mittelstufe und zwischen 20 - 40 mg. pro Tag fur fortgeschrittene Athleten, obwohl es Athleten gibt, die sogar 50 mg erreichen. Ab 30 mg. Nebenwirkungen konnen verschlimmert werden und 40-50 mg rosten. Es ist einfach, die Nebenwirkungen ohne Nutzen zu erhohen. Frauen konnen dieses Medikament nicht einnehmen. Wie man Dianabol fahrt
Um einen Zyklus fur Dianabol zu erstellen, der auf mehr Verwendung als Erganzung als Steroid basiert, mussen wir zuerst den aktuellen Trend zum Zyklus von Dianabol berucksichtigen und seine moglichen negativen Aspekte analysieren. Ein durchschnittlicher Dianabol-Zyklus ist typischerweise mit 20-40 mg Teilungen pro Tag fur 4-6 Wochen strukturiert, sowohl allein als auch in Kombination mit anderen Steroiden.
Erstens fuhrt eine Dosis von 25 mg oder haufiger zu einer Flussigkeitsretention. Es ist bekannt, dass Dianabol leicht aromatisiert, und der gro?te Teil der Flussigkeitsretention wird haufig auf eine uberma?ige Ostrogenproduktion zuruckgefuhrt. Ich bin jedoch der Meinung, dass Flussigkeitsretention ursprunglich auftritt, weil der Korper aufgrund der Auswirkungen von Dianabol auf den Mineralhaushalt des Korpers, insbesondere auf den Kalium / Natrium-Haushalt, am Wasser haftet. Dies fuhrt zusammen mit der Tatsache, dass Dianabol ostrogene Nebenwirkungen hervorruft, zu einer betrachtlichen Flussigkeitsretention. Da wir nicht viel gegen Veranderungen im Mineralhaushalt des Korpers tun konnen, konnen wir nur versuchen, die Aromatisierung zu reduzieren, normalerweise mit Nolvadex (Tamoxifen) oder anderen Antiostrogenen.
Dies ist jedoch nicht die einzige Methode: Durch die Reduzierung der Dosis aromatisiert das Arzneimittel weniger, was zu weniger Ostrogen und insbesondere zu weniger Flussigkeitsretention fuhrt. Eine Reduzierung des Arzneimittels wahrend eines Zyklus wurde zu einer langsamen Verringerung des Ostrogenspiegels fuhren. Daher sollten wir den Zyklus mit einer niedrigeren Dosis von 10 bis 20 mg pro Tag beginnen.
Das Teilen der Dosis bei einer niedrigen Dosis ist praktisch nutzlos, da ein viel niedrigerer maximaler Wirkstoffspiegel erzielt wird. In diesem Fall ist es daher besser, morgens eine Einzeldosis einzunehmen (vorzugsweise mit Grapefruitsaft). Obwohl dies die Unterdruckung von naturlichem Testosteron nicht verhindert, kann es es bis zu einem gewissen Grad reduzieren, da der Korper am Ende des Tages weiterhin lange Zeitraume mit geringer Testosteronzirkulation hat, so dass es moglich ist, dass er etwas produziert.
Wenn wir uns nun die Zyklusdauer von 4 bis 6 Wochen ansehen, scheint dies zu kurz, um bei einer so niedrigen Dosis echte Auswirkungen zu haben. Konnen wir Dianabol jedoch langer anwenden, ohne unsere Leber starker zu gefahrden?
Die Losung ist ganz einfach: Wenn wir das Medikament am Wochenende abbrechen, geben wir der Leber eine Pause, ohne das Medikament verarbeiten zu mussen. Aufgrund seiner kurzen Halbwertszeit ist jeder Wirkstoff innerhalb von 24 Stunden nach der letzten Dosis aus dem Korper ausgeschieden. Es mag den Anschein haben, dass Sie dadurch weniger verdienen, aber in Wirklichkeit bedeutet dies kaum langfristige Verluste, da der Korper zwar kein aktives Medikament hat, seine Wirkungen jedoch immer noch vorhanden sind, beispielsweise in extra intramuskularer Flussigkeit und a gro?erer anaboler Mineralhaushalt.
Diese Effekte lassen in der Regel mehrere Tage nach. Diese Methode wird jedoch das naturliche Testosteron des Korpers nicht dazu ermutigen, seinen gehemmten Zustand zu verlassen, da dieser Prozess viel langer dauern kann. Wenn wir eine niedrigere Dosis einnehmen und uns am Wochenende davon ausruhen, sollten wir Dianabol theoretisch problemlos 10 Wochen lang anwenden konnen. Ein wenig Mathematik kann diese Idee deutlicher zeigen:
6 Wochen bei 25 mg taglich = 1050 mg Dianabol insgesamt
10 Wochen Pause am Wochenende bei 15 mg pro Tag = 750 mg Dianabol insgesamt
Wie zu sehen ist, kann die Leber nach diesem System weniger Dianabol verarbeiten als in einem normalen Zyklus, zusatzlich zu der Tatsache, dass sie 10 Wochen anstelle von 6 Wochen Vorteile erzielen kann, mit weniger Nebenwirkungen und einem festen Zyklus.
Diese Zyklustheorie kann in unzahligen Situationen angewendet werden, z. B. kann ein Anfanger Dianabol nur 10 Wochen lang verwenden und sehr gute Ergebnisse erzielen. Ein erfahrener Steroidbenutzer konnte es in Verbindung mit einem injizierbaren Zyklus verwenden, um sehr gute Ergebnisse zu erzielen und die anfanglichen schnellen Vorteile von Dianabol und die langsameren, aber starkeren Vorteile des injizierbaren zu erhalten. Es gibt auch Sportler, die es als Brucke benutzen (Ruhezeit dazwischen
Zyklen), dh nach dem Nachzyklus oder vor dem Starten eines neuen. In diesem
Fall 10 mg wurde genommen werden. wenn wir beim ersten Essen aufstehen.
Diese Technik kann zur Aufrechterhaltung der Muskeln wirksam sein, ist jedoch gefahrlich fur unsere Leber.
Es mag den Anschein haben, dass dieser Zyklus den haufigsten Trends bei der Anwendung von Dianabol widerspricht, aber wenn er als Erganzung zu gutem Training und guter Ernahrung verwendet wird, kann er sehr positive Ergebnisse erzielen.
0 notes
Text
BILL OF MATERIALS (ASSIGNMENT)
BILL OF MATERIALS (ASSIGNMENT)
Company has decided to produce a new face lotion. For producing the new product required raw materials are as follows. Create the items and make the production formula.
Finished Goods: Face Lotion (U.O.M- ML)
Raw Materials: (UOM – ML) (For 100 ML of facelotion raw materials are required)
Glycerin (20 ML)
Paraffin Liquid (10 ML)
Tocopheryl (2 ML)
Hydroxilated Milk (60ML)
Rose Water (5 ML)
Essense (1 ML)
P…
View On WordPress
0 notes
Text
Sari Lightening Papaya Soap Sabun Sari Pepaya
Sari Lightening Papaya Soap Sabun Sari Pepaya
Sari Lightening Papaya Soap
Varian : Papaya & Honey
Papaya+honey kaya akan vitamin dan mineral, sangat baik untuk menjaga dan merawat kesehatan kulit. Membantu memudarkan noda hitam bekas jerawat, dengan cara mengangkat sel kulit mati. Kandungan AHA (alpha hydroxil Acid) dan enzim papain membantu mencegah penuaan dini dan memutihkan kulit. Sedangkan kandungan kakao dalam buah papaya membantu…
View On WordPress
0 notes
Photo

What Is Hydrogen? Hydrogen gas or diatomic molecular hydrogen is the chemical formula H2. It is the smallest molecule in the universe, about have the size of oxygen. This gives it a higher cellular bio-availability above any other supplement, drug or nutriceutical. Molecular Hydrogen can rapidly diffuse deep into all the human body cells and mitochondria, as well as easily pass through the blood brain barrier. Molecular Hydrogen, is not bound to any other compound, but it’s free and independently available. Water for instance, has bound hydrogen that is connected to the oxygen (H2O). But hydrogen gas on the other hand is available hydrogen H2 where the hydrogen are only bound to each other. It’s this gascious form of hydrogen that is dissolved in the water. Why is this so important and what does mean for you? Diseases and Molecular Hydrogen Well, you understand that the rates of cardiovascular disease, the diabetes, obesity and many neurological disorders such as autism, ADD, depression, Parkinson’s disease, Alzheimer’s disease, and others are extremely high in our society today. So the need for a safe and natural anti-aging remedy that brings the body back to homeostasis has never been greater. Scientific research on molecular hydrogen suggests that this long forgotten molecule may in fact be the key to the revolution of health and wellness. So How Does Molecular Hydrogen Work? Human, animal, and cell studies shows that this hydrogen exerts beneficial effects via three primary methods. It instantaneously converts the toxic hydroxil radicals in your body to water It maintains the homeostatic levels of our body’s own antioxidants It also has a beneficial effect on cell signaling, cell metabolism, and gene expression, which gives it anti-inflammatory, anti-obesity, and anti-aging effects. To be very clear about this, H2 molecular hydrogen gas is NOT a foreign substance. It isn’t and doesn’t function like a drug or pharmaceutical that are foreign and alien to your body. In fact, after a fiber-rich meal our gut bacteria produces a large amount of this hydrogen gas which diffuses into the blood and exerts many beneficial effects.
0 notes
Text
Dianabol
Dianabol je jeden
nejcasteji pouzivanych
oralni steroidy. Jeho chemicky nazev je Methandrostenolone nebo Methanedienone, 17-alfa-methyl-17beta-hydroxil-androstal.4dien-3-on. Existuje mnoho farmaceutickych a generickych variant leku, vcetne Anabol a Naposim. Je to steroid pro oralni pouziti. To bylo siroce pouzivano v 70-tych letech a je jeste pouzivano dnes pro jeho rychle a intenzivni zisky ve svalovem objemu.
Jeho pouziti velmi intenzivne stimuluje syntezu bilkovin ve svalech. Diky tomu ma dusik a vapnik pozitivni rovnovahu. Zvysuje ukladani vapniku v kostech. Vytvari pocit pohody.
Dianabol lze pouzit terapeuticky v pripadech, kdy je v dusledku toho nutny anabolicky a celkovy posilovaci ucinek. Uspesne bojuje proti osteoporoze.
To je bezne pouzivano kulturistu a kulturistu ke zvyseni jejich svalove hmoty a sily, to muze byt ziskano mezi 1 a 2 Výcvik kilogramy za tyden, behem obdobi sesti tydnu, po osme zastavi
produkujici zisky, existuji ti, kteri v tydnu 6 nebo 7 pridaji injekcni injekce jako
Decadurabolin dalsich sest tydnu, aby se pokracovalo v prirustcich.
Prestoze ma Dianabol mnoho potencialnich vedlejsich ucinku, jsou vzacne pri davkach blizkych 20 mg / den.
Dianabol ma v krvi zivotnost 3,2 az 4,5 hodiny, proto je nutne jej spolknout alespon 2krat denne, aby se dosahlo urciteho typu koncentrace latky v krvi. Ve dnech intenzivniho treninku je vhodne pouzit 3 denni davky. Doporucuje se jeho konzumace s jidlem. Pri poziti je maximalni koncentrace v krvi dosazeno po 1 az 3 hodinach.
To vede ke snizeni endogenniho kortizonu o 50 az 70%, coz je priznive pro zvyseni svalove hmoty, protoze kortikosteroidni hormony maji katabolicky ucinek.
Krome toho, Dianabol zpusobuje intenzivni zvyseni koncentrace testosteronu v krvi u muzu a nepotlacuje prirozenou osu, pouze
inhibuje to v zavislosti na davce.
Obecne dava pocit pohody a vysoke sebevedomi, zlepsuje chut k jidlu a muze zlepsit naladu.
Treti den po ukonceni pouzivani Dianabol je krevni test na latku negativni, ale pouziti steroidnich latek lze zjistit jinymi metodami. ZOBRAZIT ANABOLIZUJICI CYKLY Klinicke Pouziti Dianabol Dianabol bylo prokazano, ze zvysuje anaerobni glykolyzu, coz vede ke zvyseni telni kyseliny mlecne. To je pozitivni,
protoze svaly pouzivaji kyselinu mlecnou k tvorbe glykogenu, ktery v
tah poskytuje energii pro anaerobni metabolismus. Kyselina mlecna je take klicovou chemikalii pro eliminaci uhlohydratu ze stravy, coz znamena, ze pri pouzivani Dianabolu je mensi sance na pribirani na vaze.
Studie osteoporozy ukazala, ze v davce pouhych 2,5 mg denne po dobu 9 mesicu byl Dianabol ucinnejsi nez doplnovani vapniku pri snizovani osteoporoticke aktivity a bylo take prokazano, ze zvysuje efektivitu svalove hmoty. Dalsi studie o osteoporoze trvajici 24 mesicu ukazala ucinek Dianabolu na osteoporozu; To zvysilo celkovy obsah vapniku a drasliku v tele. To nemusi byt zajimave pro kulturisty, ale pusobeni vapniku je pro kulturistiku velmi dulezite, protoze nese velke mnozstvi aminokyselin a kreatinu, ktere jsou nezbytne pro rust svalu. Draslik je take velmi dulezity, protoze pomaha v pripadech svalove kontrakce, prenosu nervovych signalu a uvolnovani inzulinu; tim padem,
Dalsi velmi zajimava studie, i kdyz neni z hlediska kulturistiky prilis vyznamna, ukazala, ze Dianabol zvysuje citlivost nadorovych bunek hrtanu na radioterapii, a uzavrel "doporuceni pouziti tohoto hormonu behem radioterapeutickych procesu u pacientu s rakovinou hrtanu." Aromatizace Aromatizace casto se vyskytuje u Dianabol, to znamena, ze se premenuje na estrogeny, takze pouziti Nolvadexu je pri pouzivani tohoto produktu velmi dulezite. Vytvari take zadrzovani tekutin v dusledku aromatizace a pravdepodobne zmen mineralni mineralni rovnovahy, takze musime v pripade potreby kontrolovat krevni tlak a mit po ruce diuretikum. Jaterni toxicita dianabol
Vzhledem k tomu, ze je to alfa-alkylova sloucenina C 17, je toxicky pro jatra,
takze pridani silymarinu je nezbytne a zaroven jeho pouziti neomezuje
vice nez 6 - 7 tydnu. Pri vysokych davkach a po delsi dobu je Dianabol (Anabolex) toxicky pro jatra, dokonce i davka pouze 10 mg / den muze zvysit hodnoty jater, avsak po preruseni lecby se hodnoty vrati k normalnosti . Studie na potkanech ukazala, ze bez ohledu na davku nebo cas podani, Dianabol zpusobuje zmeny v enzymaticke aktivite vedouci k hypertrofii hepatocytu, coz ukazuje toxicitu Dianabol na jatra.
V jine studii vsak bylo zjisteno, ze Nerobol (rusky ekvivalent Dianabol) podporuje rychlou normalizaci funkcnich a metabolickych poruch jater, coz je v rozporu s predchozimi testy. To ukazuje, ze myslenka, ze Dianabol je nebezpecny, neni tak negativni, jak si nekteri mohou myslet. Davkovani Davka se muze pohybovat mezi 15 a 20 mg. pro zacatecniky - stredne pokrocile a mezi 20 - 40 mg. za den pro pokrocile sportovce, i kdyz existuji sportovci, kteri dosahuji dokonce 50 mg. Od 30 mg. Nezadouci ucinky mohou byt zhorseny a pecene 40-50 mg. je to proste ke zvyseni vedlejsich ucinku bez jakehokoli prinosu. Zeny tento lek nemohou vzit. Jak cyklovat Dianabol
Chcete-li vytvorit cyklus pro Dianabol zalozeny na vice pouziti jako doplnek nez steroid, musime nejprve vzit v uvahu soucasny trend cyklu Dianabol a analyzovat jeho mozne negativni aspekty. Prumerny cyklus Dianabol je obvykle strukturovan s 20-40 mg divizemi kazdy den po dobu 4-6 tydnu, a to samostatne i v kombinaci s jinymi steroidy.
Za prve, davka 25 mg nebo vice casto vede k zadrzovani tekutin. Je znamo, ze dianabol aromatizuje snadno a vetsina zadrzovani tekutin je casto pricitana nadmerne produkci estrogenu. Domnivam se vsak, ze zadrzovani tekutin se puvodne vyskytuje, protoze telo prilne k vode diky ucinkum Dianabol na mineralni rovnovahu tela, zejmena na rovnovahu draslik / sodik. To spolu s faktem, ze Dianabol zpusobuje estrogenni vedlejsi ucinky, vede ke znacne retenci tekutin; Protoze se zmenami mineralni rovnovahy v tele nemuzeme udelat mnoho, muzeme jen zkusit snizit aromatizaci, obvykle Nolvadexem (tamoxifen) nebo jinymi antiestrogeny.
To vsak neni jediny zpusob: snizenim davky bude lecivo mene aromatizovat, coz povede k mensimu mnozstvi estrogenu a zejmena k mensi retenci tekutin. Snizeni leku behem cyklu by vedlo k pomalemu snizovani hladin estrogenu, takze bychom meli cyklus zacit s nizsi davkou 10-20 mg kazdy den.
Deleni davky, kdyz nasleduje nizka davka, je prakticky zbytecne, protoze bude dosazeno mnohem nizsi maximalni hladiny leku. Proto je v tomto pripade lepsi uzit jednu davku rano (nejlepe s grapefruitovou stavou). Ackoli to nezabrani potlaceni prirodniho testosteronu, muze jej do urcite miry snizit, protoze telo bude mit na konci dne dlouha obdobi s malym obehem testosteronu, takze je mozne, ze nektere produkuje.
Nyni, kdyz se podivame na delku cyklu, zda se, ze 4-6 tydnu je prilis kratka na to, aby mela skutecne ucinky pri tak nizke davce, ale muzeme Dianabol pouzivat dele, aniz by nase jatra byla vice ohrozena?
Reseni je velmi jednoduche: kdyz prestaneme uzivat lek o vikendech, dame jatru prestavku, aniz bychom museli lek zpracovavat. Vzhledem k jeho kratkemu polocasu bude jakakoli ucinna latka mimo telo do 24 hodin od posledni davky; Mohlo by se zdat, ze vam to vydela mene, ale ve skutecnosti to bude stezi znamenat dlouhodobe ztraty, protoze ackoli telo nema aktivni lek, jeho ucinky jsou stale pritomny napriklad v extra intramuskularni tekutine a vetsi anabolicka mineralni rovnovaha.
Tyto ucinky obvykle zmizi po dobu nekolika dnu. Tato metoda vsak nebude povzbuzovat prirozeny testosteron v tele, aby vysel ze sveho inhibovaneho stavu, protoze tento proces muze trvat mnohem dele. Pokud vezmeme nizsi davku a odpocineme o ni o vikendech, teoreticky bychom meli byt schopni pouzivat Dianabol po dobu 10 tydnu bez problemu. Trochu matematiky muze jasneji ukazat tento napad:
6 tydnu pri 25 mg denne = celkem 1050 mg Dianabol
10 tydenni prestavka o vikendech v 15 mg kazdy den = 750 mg celkem Dianabol
Jak je tedy videt, tento system umoznuje, aby jatra zpracovavala mene Dianabol nez v normalnim cyklu, krome skutecnosti, ze muze ziskat vyhody po dobu 10 tydnu misto 6, s mene vedlejsimi ucinky a ziskanim pevneho cyklu.
Tuto teorii cyklu lze pouzit v nescetnych situacich, napr. Zacatecnik muze pouzivat Dianabol pouze po dobu 10 tydnu a dosahnout velmi dobrych vysledku. Zkusenejsi uzivatel steroidu by ho mohl pouzit ve spojeni s injekcnim cyklem, aby ziskal velmi dobre vysledky, ziskal pocatecni rychle vyhody Dianabol a pomalejsi, ale silnejsi vyhody injekcni. Existuji take sportovci, kteri jej pouzivaji jako most (doba odpocinku mezi
cykly), tj. po skonceni cyklu nebo pred zahajenim noveho cyklu. V tomhle
vezme se 10 mg. kdyz vstavame pri prvnim jidle.
Tato technika muze byt ucinna pri udrzovani svalu, ale nebezpecna pro nasi jatra.
Muze se zdat, ze tento cyklus je v rozporu s nejbeznejsimi trendy v pouzivani Dianabol, ale jeho pouzitim jako doplnku dobreho treninku a vyzivy muze dosahnout velmi pozitivnich vysledku.
0 notes