#metastatik meme kanseri
Text
HER2 pozitif meme kanseri ve HER2 negatif meme kanseri: Fark nedir?
Çoğu meme kanseri türü benzer semptomlara neden olur ve aynı şekilde keşfedilir: Kendi kendinize muayene sırasında garip yeni bir şişlik bulursunuz veya mamografi sırasında doktor şüpheli bir şey keşfeder. Ancak daha derin bir düzeyde, farklı meme kanseri türleri çok farklı davranabilir. Tipik olarak, yalnızca göğüs biyopsisi (bir göğüs tümöründen alınan doku örneği laboratuvara gönderildiğinde)…

View On WordPress
0 notes
Text
Yapay zeka, kanserin kaynağını metastatik hücrelerden doğru şekilde belirlemeyi öğrendi
Geleneksel olarak kanser tesadüfen tespit edilir. Bu ne kadar erken yapılırsa hastanın hayatta kalma şansı o kadar yüksek olur. Ancak çoğu zaman hastalığın kaynağı bilinmemektedir ve insanlar bunu, kişinin lenf veya diğer biyolojik sıvılarında metastatik hücrelerin ortaya çıkmasıyla öğrenirler. Doktorlar bunlardan bazılarını tanımayı öğrendi, ancak metastatik hücreleri kanser türleriyle ilişkilendirmek hâlâ zorlu bir iş olmaya devam ediyor ve yapay zeka, bunu daha iyi yapabilecek bir araç.
Tianjin Üniversitesi'nden bir grup Çinli bilim insanı, Nature dergisinde metastatik hücre türlerini tanımak için yapay zekayı eğitme konusundaki kendi deneyimlerini paylaştıkları bir makale yayınladı. Akciğer, yumurtalık, meme ve mide kanseri dahil olmak üzere kanser hücrelerinin akciğer sıvısına ve karın sıvısına salınmasının eşlik ettiği en yaygın onkolojinin 12 tipini temel aldılar. Prostat bezi ve böbreklerde ortaya çıkanlar da dahil olmak üzere diğer bazı kanser türleri, genellikle metastatik hücreleri insan vücut sıvılarına salmadıkları için çalışmaya dahil edilemedi.
Bilim adamlarına göre, her yıl üniversite hastanesinde tedavi gören 13bin kanser hastasından yaklaşık 4.000 vakaya doktorlar tarafından metastatik hücrelerin görüntüleri incelenerek teşhis konuluyor, ancak yaklaşık 300 kişi kanserin kaynağını tespit edemeden kalıyor ve bunların akıbeti değişiyor. Kansere karşı evrensel bir tedavi yöntemi yoktur; her vaka için farklıdır, bu nedenle tanı konmayan hastalar arasında hayatta kalma oranı çok düşüktür.
Araştırmacılar yapay zeka modellerini, tümör kökeni bilinen 21.000 kişinin periton boşluğunda veya akciğer sıvısında bulunan yaklaşık 30.000 metastatik hücre görüntüsü üzerinde eğitti. Daha sonra modellerini 27.000 metastatik hücre örneği görüntüsü üzerinde test ettiler ve yüzde 83'ünün kanser kaynağının tanındığını buldular. Üstelik yapay zeka tarafından seçilen metastaz hücrelerinin kaynağı için ilk üç aday doğrulukla hedefi tutturuyor ancak metastazların ortaya çıkması oldukça gelişmiş bir onkolojinin sinyalidir ve tanıda gecikme kabul edilemez.
Son olarak yaklaşık 500 görüntünün analizinde yapay zekanın deneyimli doktorlardan daha iyi bir tahminci olduğu kanıtlandı. AI öngörüsü ve doktorların tahminlerine göre dört yıl önce tedavi gören 391 hastadan oluşan bir grup da incelendi. Tedavinin seyri AI'nin prognozuna uygunsa, hastaların hayatta kalma oranının daha yüksek olduğu ve doktorlar AI'nin prognozunu hesaba katmadıysa, o zaman daha düşük olduğu ortaya çıktı. Araştırmacılar, diğer kanser teşhis yöntemleriyle birleştirildiğinde, metastatik hücreleri tanımlayarak tümörlerin kaynağını tanımak için yapay zekanın kullanılmasının, bu ölümcül hastalığın tedavi edilme olasılığını önemli ölçüde artırmayı vaat ettiğini söylüyor.
Read the full article
0 notes
Link
“BAZI KİŞİLER HİÇ SEMPTOM GÖSTERMEYEBİLİR” Türkiye'de ve dünyada kadınlarda en sık görülen ve yaşam boyu her 8 kadından 1'inin yakalanma ihtimali olan meme kanserine ilişkin değerlendirmede bulunan G... ---------------------------- Haberin devamı haber71.net'te.
0 notes
Text
Beyin Tümörü Türleri: Belirtileri, Tedavisi ve Risk Faktörleri

İçindekilerİyi Huylu Beyin Tümörü TürleriKötü Huylu Beyin Tümörü TürleriDiğer Beyin Tümörü TürleriBeyin Tümörü NedenleriSemptomlarTeşhisBeyin Tümörü TedavisiAmeliyatRadyasyon tedavisiKemoterapi
İntrakraniyal tümör olarak bilinen bir beyin tümörü, hücrelerin normal hücreleri kontrol eden mekanizmalar tarafından görünüşte kontrol edilemeyen, kontrolsüz bir şekilde büyüdüğü ve çoğaldığı anormal bir doku kütlesidir. 150’den fazla farklı beyin tümörü belgelenmiştir, ancak iki ana beyin tümörü grubu birincil ve metastatik olarak adlandırılır .
Birincil beyin tümörleri, beyin dokularından veya beynin yakın çevresinden kaynaklanan tümörleri içerir. Birincil tümörler glial ( glial hücrelerden oluşan ) veya glial olmayan (sinirler, kan damarları ve bezler dahil beyin yapıları üzerinde veya içinde gelişen) ve iyi huylu veya kötü huylu olarak kategorize edilir .
Metastatik beyin tümörleri , vücudun başka bir yerinde (meme veya akciğerler gibi) ortaya çıkan ve genellikle kan dolaşımı yoluyla beyne göç eden tümörleri içerir. Metastatik tümörler kanser olarak kabul edilir ve kötü huyludur.
Beyindeki metastatik tümörler, kanserli dört hastadan yaklaşık birini veya yılda tahmini 150.000 kişiyi etkiler. Akciğer kanseri olan kişilerin yüzde 40’ına kadar metastatik beyin tümörleri gelişecektir. Geçmişte, bu tümörlerin teşhisi konan hastaların sonuçları, sadece birkaç haftalık tipik hayatta kalma oranları ile çok zayıftı. Yenilikçi cerrahi ve radyasyon yaklaşımlarına ek olarak daha sofistike teşhis araçları, hayatta kalma oranlarının yıllara kadar artmasına yardımcı oldu; ve ayrıca teşhisi takiben hastalar için daha iyi bir yaşam kalitesi sağlamıştır.
İyi Huylu Beyin Tümörü Türleri
Kordomalar , 50 ila 60 yaşları arasındaki insanlarda en yaygın olan iyi huylu, yavaş büyüyen tümörlerdir. En yaygın yerleri kafatasının tabanı ve omurganın alt kısmıdır. Bu tümörler iyi huylu olmalarına rağmen, komşu kemiği istila edebilir ve yakındaki nöral dokuya baskı uygulayabilir. Bunlar, tüm birincil beyin tümörlerinin yalnızca yüzde 0,2’sine katkıda bulunan nadir tümörlerdir.
Kraniofarenjiyomlar tipik olarak iyi huyludur, ancak beynin derinliklerinde kritik yapıların yakınında bulundukları için çıkarılması zor tümörlerdir. Genellikle hipofiz bezinin bir kısmından (vücuttaki birçok hormonu düzenleyen yapı) ortaya çıkarlar, bu nedenle neredeyse tüm hastalar bir miktar hormon replasman tedavisine ihtiyaç duyacaktır.
Gangliositomalar , gangliomlar ve anaplastik gangliogliomalar ,esas olarak genç erişkinlerde ortaya çıkan, nispeten iyi farklılaşmış neoplastik sinir hücrelerini içeren nadir tümörlerdir.
Glomus jugulare tümörleri en sık iyi huyludur ve tipik olarak juguler venin üst kısmında kafa tabanının hemen altında bulunur. Glomus tümörünün en yaygın şeklidirler. Bununla birlikte, glomus tümörleri genel olarak baş ve boyun neoplazmalarının yalnızca yüzde 0,6’sına katkıda bulunur.
Meningiomlar en yaygın benign intrakraniyal tümörlerdir ve tüm beyin neoplazmalarının yüzde 10 ila 15’ini oluşturur, ancak çok küçük bir yüzdesi maligndir. Bu tümörler, beyni ve omuriliği çevreleyen zar benzeri yapılar olan meninkslerden kaynaklanır.
Pineositomlar , epifiz hücrelerinden kaynaklanan , çoğunlukla yetişkinlerdeortaya çıkan genellikle iyi huylu lezyonlardır. Çoğunlukla iyi tanımlanmış, invaziv olmayan, homojen ve yavaş büyüyenlerdir.
Hipofiz adenomları , gliomlar, menenjiyomlar ve schwannomlardan sonra en sık görülen intrakraniyal tümörlerdir. Hipofiz adenomlarının büyük çoğunluğu iyi huyludur ve oldukça yavaş büyür. Kötü huylu hipofiz tümörleri bile nadiren vücudun diğer bölgelerine yayılır. Adenomlar, hipofiz bezini etkileyen en yaygın hastalıktır. Çocuklarda da teşhis edilmelerine rağmen, genellikle 30’lu veya 40’lı yaşlarındaki insanları etkilerler. Bu tümörlerin çoğu başarıyla tedavi edilebilir.
Schwannomalar yetişkinlerde sık görülen iyi huylu beyin tümörleridir. Normalde sinir hücreleri için “elektriksel yalıtım” sağlayan hücrelerden oluşan sinirler boyunca ortaya çıkarlar. Schwannomalar genellikle normal sinirin geri kalanını istila etmek yerine geri alır. Akustik nöromalar , beyinden kulağa giden sekizinci kraniyal sinirden veya vestibüler koklear sinirden kaynaklanan en yaygın schwannomadır . Bu tümörler iyi huylu olmalarına rağmen, büyüyüp sinirlere ve nihayetinde beyne baskı uygularlarsa ciddi komplikasyonlara ve hatta ölüme neden olabilirler. Diğer yerler arasında omurga ve daha nadiren uzuvlara giden sinirler bulunur.
Kötü Huylu Beyin Tümörü Türleri
Gliomalar , en yaygın yetişkin beyin tümörü türüdür ve kötü huylu beyin tümörlerinin yüzde 78’ini oluşturur. Glia adı verilen beynin destekleyici hücrelerinden doğarlar . Bu hücreler astrositlere , ependimal hücrelere ve oligodendroglial hücrelere (veya oligos)bölünmüştür. Glial tümörler şunları içerir:
Astrositomlar , tüm birincil beyin ve omurilik tümörlerinin yaklaşık yarısını oluşturan en yaygın gliomadır. Astrositomlar, beynin destek dokusunun bir parçası olan astrositler adı verilen yıldız şeklindeki glial hücrelerden gelişir. Beynin pek çok yerinde meydana gelebilirler, ancak en çok serebrumda meydana gelirler. Her yaştan insan astrositom geliştirebilir, ancak yetişkinlerde, özellikle orta yaşlı erkeklerde daha yaygındır. Beynin tabanındaki astrositomlar çocuklarda veya genç insanlarda daha yaygındır ve çocukların beyin tümörlerinin çoğunu oluşturur. Çocuklarda, bu tümörlerin çoğu düşük dereceli olarak kabul edilirken, yetişkinlerde çoğu yüksek derecelidir.
Ependimomlar , ventriküler sistemi kaplayan ependimal hücrelerin neoplastik dönüşümünden türetilirve tüm beyin tümörlerinin yüzde iki ila üçünü oluşturur. Çoğu iyi tanımlanmıştır, ancak bazıları değildir.
Glioblastoma multiforme (GBM) en invaziv glial tümör türüdür. Bu tümörler hızlı büyüme, diğer dokulara yayılma ve kötü prognoza sahip olma eğilimindedir. Astrositler ve oligodendrositler gibi birkaç farklı hücre türünden oluşabilirler. GBM, 50 ila 70 yaş arası kişilerde daha yaygındır ve erkeklerde kadınlardan daha yaygındır.
Medulloblastomlar genellikle beyincikte , en sık çocuklarda ortaya çıkar. Yüksek dereceli tümörlerdir, ancak genellikle radyasyona ve kemoterapiye yanıt verirler.
Oligodendrogliomalar , beynin kablolarının yalıtımı olan miyelini yapan hücrelerden elde edilir.
Diğer Beyin Tümörü Türleri
Hemanjiyoblastomlar , genellikle serebellumda bulunan, yavaş büyüyen tümörlerdir. Kan damarlarından kaynaklanırlar, büyük olabilirler ve sıklıkla bir kistle birlikte bulunurlar. Bu tümörler en çok 40 ila 60 yaşlarındaki kişilerde görülür ve erkeklerde kadınlardan daha yaygındır.
Rhabdoid tümörler , merkezi sinir sistemine yayılma eğiliminde olan nadir, oldukça agresif tümörlerdir. Genellikle vücudun birden çok yerinde, özellikle böbreklerde görülürler. Küçük çocuklarda daha yaygındır, ancak yetişkinlerde de görülebilir.
Pediatrik Beyin Tümörleri
Çocuklarda beyin tümörleri tipik olarak yetişkinleri etkileyenlerden farklı dokulardan gelir. Yetişkin beyni tarafından oldukça iyi tolere edilen tedaviler (radyasyon tedavisi gibi), özellikle beş yaşından küçük çocuklarda bir çocuğun beyninin normal gelişimini engelleyebilir.
Göre Pediatrik Beyin Tümörü Vakfı 15 yaş daha genç, yaklaşık 4,200 çocuk beyin tümörü tanısı alan çocukların ABD Yetmiş iki yüzde bir beyin tümörü teşhisi are bunlar beyin tümörlerinin çoğu arka çukur yetişen (veya arka ) beyin. Çocuklar genellikle hidrosefali (beyinde sıvı birikmesi) veya yüz veya vücut düzgün çalışmama ile başvurur.
Çocuklarda bazı beyin tümörü türleri yetişkinlerden daha yaygındır. En yaygın pediatrik tümör tipleri medulloblastomalar, düşük dereceli astrositomlar (pilositik) , ependimomlar, kraniyofaringiyomlar ve beyin sapı gliomalarıdır .
Dünya Sağlık Örgütü (WHO) mikroskop altında histolojik özellikleri dayalı bir tümörün malignite veya kalpliliği belirtmek için not verme sistemi geliştirmiştir.
En kötü huylu
Hızlı büyüme, agresif
Yaygın olarak sızan
Hızlı tekrarlama
Nekroz eğilimli
Yetişkinlerde Görülme Sıklığı
Ulusal Kanser Enstitüsü 22910 yetişkin (12630 erkek ve 10280 kadın) 2012 yılında beyin ve diğer sinir sistemi tümörleri teşhisi konacak Ayrıca 2012 yılında, bu tanıların 13,700 ölüme yol olacağını tahmin tahmin ediyor.
2005 ve 2009 yılları arasında, beyin kanserinden ve sinir sisteminin diğer bölgelerinden ölüm için medyan yaş 64 idi.
https://youtu.be/Z5smVBYdYq0
Beyin Tümörü Nedenleri
Beyin tümörlerinin, bir hücrenin kromozomları üzerindeki belirli genler hasar gördüğünde ve artık düzgün çalışmadığında ortaya çıktığı düşünülmektedir . Bu genler normalde hücrenin bölünme hızını (eğer bölünürse) düzenler ve diğer genlerin kusurlarını düzelten genleri ve hasarın onarılamayacaksa hücrenin kendi kendini yok etmesine neden olması gereken genleri onarır. Bazı durumlarda, bir birey bu genlerin bir veya daha fazlasında kısmi kusurlarla doğabilir. Çevresel faktörler daha sonra daha fazla hasara yol açabilir. Diğer durumlarda, genlerin çevresel zararı tek neden olabilir. Bir “çevrede” bazı insanların neden beyin tümörü geliştirirken diğerlerinin gelişmediği bilinmemektedir.
Bir hücre hızla bölündüğünde ve büyümesini kontrol etmek için iç mekanizmalar hasar gördüğünde, hücre sonunda bir tümöre dönüşebilir. Diğer bir savunma hattı, anormal hücreyi en iyi şekilde tespit edip öldürecek olan vücudun bağışıklık sistemi olabilir. Tümörler, bağışıklık sisteminin anormal tümör hücrelerini tanımasını engelleyen maddeler üretebilir ve sonunda tüm iç ve dış caydırıcıların büyümesini engelleyebilir.
Hızla büyüyen bir tümör, normal dokuya yönelik yerel kan kaynağının sağlayabileceğinden daha fazla oksijene ve besine ihtiyaç duyabilir. Tümörler, kan damarlarının büyümesini destekleyen, anjiyogenez faktörleri adı verilen maddeler üretebilirler . Büyüyen yeni damarlar, tümöre besin tedarikini arttırır ve sonunda tümör, bu yeni damarlara bağımlı hale gelir. Bu alanda araştırmalar yapılmaktadır, ancak bu bilgiyi potansiyel tedavilere dönüştürmek için daha kapsamlı araştırmalar gereklidir.
Semptomlar
Semptomlar beyin tümörünün konumuna göre değişir, ancak aşağıdakiler farklı beyin tümörlerine eşlik edebilir:
1-Sabahları daha şiddetli olabilen veya geceleri hastayı uyandıran baş ağrıları
2-Nöbetler veya konvülsiyonlar
3-Düşünme, konuşma veya ifade etme zorluğu
4-Kişilik değişiklikleri
5-Vücudun bir bölümünde veya bir tarafında zayıflık veya felç
6-Denge kaybı veya baş dönmesi
7-Vizyon değişiklikleri
8-İşitme değişiklikleri
9-Yüzde uyuşma veya karıncalanma
10-Bulantı veya kusma , yutma zorlukları
11-Karışıklık ve yönelim bozukluğu
Teşhis
Gelişmiş görüntüleme teknikleri beyin tümörlerini tam olarak belirleyebilir. Teşhis araçları arasında bilgisayarlı tomografi (CT veya CAT taraması) ve manyetik rezonans görüntüleme (MRI) bulunur . Diğer MRG dizileri, cerrahın beynin normal sinir yollarının konumuna göre tümörün rezeksiyonunu planlamasına yardımcı olabilir. İntraoperatif MRG ayrıca ameliyat sırasında doku biyopsilerine ve tümörün çıkarılmasına rehberlik etmek için kullanılır . Manyetik rezonans spektroskopi (MRS) , tümörün kimyasal profilini incelemek ve MRI’da görülen lezyonların doğasını belirlemek için kullanılır. Pozitron emisyon tomografisi (PET taraması) , tekrarlayan beyin tümörlerini tespit etmeye yardımcı olabilir.
Bazen bir beyin tümörünün kesin teşhisini koymanın tek yolu biyopsidir. Beyin cerrahı biyopsi yapar ve patolog, tümörün iyi huylu mu yoksa kötü huylu mu göründüğünü belirleyerek nihai teşhisi koyar ve buna göre derecelendirir.
Beyin Tümörü Tedavisi
Beyin tümörleri (birincil veya metastatik, iyi huylu veya kötü huylu) genellikle tek başına veya çeşitli kombinasyonlarda cerrahi, radyasyon ve / veya kemoterapi ile tedavi edilir. Radyasyon ve kemoterapinin kötü huylu, rezidüel veya nükseden tümörler için daha sık kullanıldığı doğru olsa da, hangi tedavinin kullanılacağına dair kararlar duruma göre verilir ve bir dizi faktöre bağlıdır. Her tedavi türü ile ilişkili riskler ve yan etkiler vardır.
Ameliyat
Genel olarak, bir beyin tümörünün cerrahi olarak tamamen veya neredeyse tamamen çıkarılmasının bir hasta için faydalı olduğu kabul edilir. Beyin cerrahının görevi, hastanın nörolojik işlevi için önemli olan beyin dokusuna (konuşma, yürüme vb.) Zarar vermeden mümkün olduğu kadar çok tümörü çıkarmaktır. Geleneksel olarak, beyin cerrahları , tümöre erişebilmelerini ve olabildiğince çoğunu çıkarabilmelerini sağlamak için kafatasını bir kraniyotomi yoluyla açar . Beyin ameliyattan kurtulurken normal beyin sıvısını boşaltmak için ameliyat sırasında beyin sıvısı boşluklarında bir dren (EVD) bırakılabilir.
Bazen bir kraniyotomiden önce sıklıkla gerçekleştirilen bir başka işleme stereotaktik biyopsi denir . Bu daha küçük operasyon, doktorların doğru bir teşhis koyması için doku elde etmesine izin verir. Genellikle hastanın başına bir çerçeve takılır, bir tarama yapılır ve daha sonra hasta, anormal alana erişim sağlamak için kafatasına küçük bir delik açıldığı ameliyat alanına götürülür. Lezyonun konumuna bağlı olarak, bazı hastaneler aynı işlemi çerçeve kullanmadan yapabilir. Mikroskop altında incelenmek üzere küçük bir numune alınır.
1990’ların başında, cerrahi navigasyon sistemleri adı verilen bilgisayarlı cihazlar piyasaya sürüldü. Bu sistemler beyin cerrahına tümörler için rehberlik, lokalizasyon ve oryantasyon konusunda yardımcı oldu. Bu bilgi riskleri azalttı ve tümörün çıkarılma kapsamını iyileştirdi. Çoğu durumda, cerrahi navigasyon sistemleriönceden ameliyat edilemeyen tümörlerin kabul edilebilir risklerle eksize edilmesine izin verildi. Bu sistemlerden bazıları, kafatasına bir çerçeve takmak zorunda kalmadan biyopsi için de kullanılabilir. Bu sistemlerin bir sınırlaması, beyin cerrahına rehberlik etmek için ameliyattan önce elde edilen bir taramayı (CT veya MRI) kullanmalarıdır. Bu nedenle intraoperatif olarak oluşabilecek beyin hareketlerini açıklayamazlar. Araştırmacılar, ameliyat sırasında navigasyon sistemi verilerinin güncellenmesine yardımcı olmak için ultrason kullanarak teknikler geliştiriyor ve MRI tarayıcılarında ameliyat gerçekleştiriyor.
İntraoperatif dil haritalama, bazıları tarafından büyük, dominant-hemisfer gliomlar gibi dil işlevini etkileyen tümörleri olan hastalar için kritik öneme sahip bir teknik olarak kabul edilir. Bu prosedür, bilinci açık bir hastanın ameliyat edilmesini ve ameliyat sırasında dil işlevinin anatomisinin haritalanmasını içerir. Doktor daha sonra tümörün hangi kısımlarının rezeke edilmesinin güvenli olduğuna karar verir. Son çalışmalar, kortikal dil haritalamasının, temel dil bölgelerini korurken glioma rezeksiyonunu optimize etmek için güvenli ve etkili bir yardımcı olarak kullanılabileceğini belirlemiştir.
Beyin tümörlü bazı hastalarda ventriküloperitoneal şant gerekebilir. Herkesinbeyninde ve her zaman yavaşça dolaşan omurgada beyin omurilik sıvısı (BOS) vardır. Bu akış tıkanırsa, sıvıyı (ventriküller) içeren keseler genişleyebilir ve kafa içinde artan basınç oluşturarak hidrosefali denen bir duruma neden olabilir. Hidrosefali tedavi edilmezse beyin hasarına ve hatta ölümeneden olabilir. Beyincerrahı, omurilik sıvısını beyinden uzaklaştırmak ve dolayısıyla basıncı düşürmek içinbir şant kullanmaya karar verebilir. CSF’nin yönlendirildiği vücut boşluğu genellikle periton boşluğudur.(karın organlarını çevreleyen alan). Şant genellikle kalıcıdır. Engellenirse, semptomlar hidrosefali orijinal durumuna benzerdir ve diğerleri arasında baş ağrısı, kusma, görsel problemler ve / veya kafa karışıklığı veya uyuşukluğu içerebilir. Beyin sıvısı yollarının tıkanmasını kontrol etmek için kullanılabilecek başka bir yönteme Endoskopik Üçüncü Ventrikülostomi denir. Bu, beyin sıvısının bir şanta ihtiyaç duyulmadan tıkanıklığın etrafından yönlendirilmesine yardımcı olur.
Radyasyon tedavisi
Radyasyon tedavisi, kanser hücrelerini ve anormal beyin hücrelerini öldürmek ve tümörleri küçültmek için yüksek enerjili X ışınları kullanır. Tümör ameliyatla etkili bir şekilde tedavi edilemezse radyasyon tedavisi bir seçenek olabilir.
Standart Harici Işın Radyoterapisi , dozu çevreleyen normal yapılarla sınırlarken tümörün uyumlu bir kapsamını oluşturmak için çeşitli radyasyon ışınları kullanır. Modern iletim yöntemleriyle uzun süreli radyasyon hasarı riski çok düşüktür. 3 boyutlu konformal radyoterapi (3DCRT) dışında daha yeni uygulama teknikleriarasında yoğunluk ayarlı radyoterapi (IMRT) bulunmaktadır .
Proton Işın Tedavisi , bir tür radyoaktivite olan protonların spesifik olarak tümöre yönlendirildiği spesifik bir radyasyon türü kullanır. Bunun avantajı, tümörü çevreleyen daha az dokunun hasara yol açmasıdır.
Stereotaktik Radyocerrahi ( Gamma Knife , Novalis ve Cyberknife gibi ) , radyasyonu hedef doku üzerine birçok farklı ışınla odaklayan bir tekniktir. Bu tedavi, tümöre komşu dokulara daha az zarar verme eğilimindedir. Şu anda, bir uygulama sisteminin klinik sonuç açısından diğerinden üstün olduğunu ve her birinin avantajları ve dezavantajları olduğunu gösteren hiçbir veri yoktur.
Kemoterapi
Kemoterapinin genellikle spesifik pediatrik tümörler, lenfomalar ve bazı oligodendrogliomalariçin etkili olduğu düşünülmektedir. Kemoterapinin, en kötü huylu birincil beyin tümörlerine sahip hastalarda genel sağkalımı iyileştirdiği kanıtlanmış olsa da, bunu tüm hastaların sadece yaklaşık yüzde 20’sinde yapar ve doktorlar, tedaviden önce hangi hastaların fayda göreceğini kolayca tahmin edemezler. Bu nedenle, bazı doktorlar olası yan etkiler ( akciğerde yara izi , bağışıklık sisteminin baskılanması, bulantı vb.) Nedeniyle kemoterapi kullanmamayı tercih etmektedir.
Kemoterapi, normal doku tarafından tümör dokusundan daha iyi tamir edilen hücre hasarına neden olarak çalışır. Kemoterapiye direnç, ilaca yanıt veremeyen tümör dokusunun hayatta kalmasını veya ilacın kan dolaşımından beyne geçememesini içerebilir. Kan dolaşımı ile beyin dokusu arasında kan-beyin bariyeri adı verilen özel bir bariyer vardır . Bazı araştırmacılar bu engeli bozarak veya ilacı tümöre veya beyne enjekte ederek kemoterapinin etkisini iyileştirmeye çalıştılar. Başka bir ilaç sınıfının amacı, tümör hücrelerini öldürmek değil, daha çok tümör büyümesini engellemektir. Bazı durumlarda, büyüme değiştiriciler (meme kanseri tedavi ilacı Tamoksifen gibi)) diğer tedavilere dirençli tümörlerin büyümesini durdurmaya çalışmak için kullanılmıştır.
1996’da ABD Gıda ve İlaç Dairesi , ameliyat sırasında beyin cerrahı tarafından uygulanabilen kemoterapi emdirilmiş gofretlerin kullanımını onayladı. Gofretler ilacı yavaş yavaş tümöre salgılar ve hasta tedavinin sistemik yan etkileri ile kemoterapi alır.
Visualase
Lazer Termal Ablasyon, bazı merkezlerin, özellikle önceki açık cerrahi prosedürleri kullanarak ulaşılması daha zor olabilecek alanlarda daha küçük tümörleri tedavi etmek için kullandığı daha yeni bir tekniktir. Bu, lezyonun içine küçük bir kateter yerleştirmeyi, muhtemelen bir biyopsiyi tamamlamayı ve ardından lezyonu termal olarak çıkarmak için lazer kullanmayı içerir. Bu teknik, son zamanlarda beyin tümörü tedavilerinde kullanıldı, bu nedenle uzun vadeli etkinlik belirlenemedi.
Araştırma Tedavileri
Halihazırda pek çok yeni tedavi türü, özellikle de mevcut geleneksel tedaviler yoluyla prognozun genellikle zayıf olduğu tümörler üzerinde incelenmektedir. Bu tedavilerin işe yarayıp yaramayacağı bilinmemektedir. Bu tür terapiler bir protokole göre verilir ve çeşitli immünoterapi formlarını, hedeflenen toksinleri kullanan terapiyi, anti-anjiyogenez terapisini, gen terapisini ve farklılaşma terapisini içerir. Tedavi kombinasyonları, olumsuz yan etkileri azaltırken, hastaların görünümünü iyileştirebilir.
Beyin Tümörleri Nedir?Beyin tümörleri, beyin dokusunda anormal hücrelerin büyümesi sonucu oluşan kitlelerdir. Bu tümörler, beyin fonksiyonlarını etkileyebilir ve ciddi sağlık sorunlarına neden olabilir.2. Belirtileri Nelerdir?Beyin tümörlerinin belirtileri, tümörün büyüklüğüne ve konumuna bağlı olarak değişebilir.
Read the full article
0 notes
Text
Karaciğer Kanseri ve Karaciğer Sirozu Nedir?
Karaciğer Kanseri ve Karaciğer Sirozu Nedir? Bu soru çok merak ediliyor; siz veya bir yakınınızın Karaciğer kanseri olduğundan şüpheleniyorsanız, bunun ne olduğunu ve nasıl teşhis edildiğini bilmek en doğal hakkınız. İnternette bununla ilgili binlerce yazı var. Ancak derli toplu bilgiyi size bir arada verebilen, ne aradığınız bilerek size en yararlı bilgiyi veren az sayıda içerik bulunuyor. Biz de sizin için bu içeriği hazırlayarak karaciğer kanseri konusunda sizleri bilgilendirmek istiyoruz.
Karaciğer kanseri semptomları ve tedavi seçenekleri farklıdır. Diğer kanser türlerinden bağımsız olarak, karaciğer kanseri, evreyi belirlemek için daha fazla test gerektirecektir. Diğer testler arasında kemik taramaları, bağırsak, meme ve mide muayeneleri ve laparoskopi adı verilen cerrahi bir prosedür yer alabilir. Doktorunuzun karaciğer kanserinden şüpheleri varsa kontroller önem kazanıyor.
Karaciğer Sirozu Nedir?
Ölümcül hastalıklardan biri olan Karaciğer sirozu nedir sorusunun cevabını arıyorsanız belli belirtileriniz var demektir. Karaciğer sirozu, çeşitli semptomları olan yaygın bir karaciğer hastalığıdır. Bazı durumlarda, hastalık a-semptomatiktir ve hiçbir belirtisi görülmez. Ancak dikkat edilmesi gereken bazı siroz uyarı işaretleri vardır. Bu yazıda, bu uyarı işaretlerinden bazılarının üzerinden geçeceğiz.
Karaciğer sirozunun ayırıcı bir özelliği, karaciğerin sert ve yumrulu olması ve kanın karaciğerden akmasını engellemesidir. Bunun için de basit ultrason testleri yapılıyor. Karaciğer gerekli proteinleri üretemediği için kan pompalamakta güçlük çeker. Bu olduğunda, portal damar tıkanır ve kanı karaciğere getiren basıncı arttırır. Bu, kanın yedeklenmesine neden olarak karın veya bacaklarda sıvı toplanmasına neden olur. Bazı hastalarda bu damarda artan basınç nedeni ile yemek borusu veya midede varisler ortaya çıkar.
Karaciğer Kanseri Nedenleri
Karaciğer kanseri nedenleri bilinmiyor doktorlar size şişmanlık, çok içki içmek hepatit virüsü gibi faktörleri sıralayacaklardır. Ancak günümüzde en yaygın olan nedenlerden bazılarını biliyoruz. Karaciğer kanseri hem erkeklerde hem de kadınlarda görülür. Tipik olarak kolonda başlasa da karaciğere yayılan kansere metastatik kanser de denir. Kanser ilk kez başka bir organda teşhis edildiğinden kanser hücreleri kolondan karaciğere yayılır. Kanserli oldukları için, metastatik kanser, ona neden olan orijinal organla aynı isimde ve türde kanser hücrelerine sahiptir.
Ailede hastalık öyküsü bulunmasına ek olarak, karaciğer kanseri taraması işlemi; risk faktörlerinin belirlenmesini ve nasıl tespit edileceğini içerir. Genellikle yüksek risk grubundaki kişiler için tarama önerilir ve düzenli olarak muayene edilmeleri gerekir. Kan testleri ve ultrason, hastalığı tespit etmek için yaygın olarak kullanılan iki yöntemdir ve bunlar ayrıca doktorlara karaciğerinizin düzgün çalışıp çalışmadığını da gösterebilir. Karaciğer kanseri olabileceğinizi düşünüyorsanız, vakit kaybetmeyin! Bu iş şakaya gelmez. Karaciğer hastalığı sizi yavaş yavaş öldürür.
Karaciğer Kanseri Tedavisi
Karaciğer kanseri tedavisi travmatik bir deneyimdir. Tedavi sırasında, tüm tedavi seçeneklerini oturup doktorunuzla görüşmeniz önemlidir. Doktorunuza anlamadığınız her şeyi sormalısınız. Tedaviyle ilgili beklentilerinizi tartışmalısınız. Farklı karaciğer kanseri türleri için farklı tedavi türleri etkilidir, bu nedenle hangi seçeneklerin sizin için en iyi sonucu vereceğini bilmek önemlidir. Ayrıca her tedavinin yan etkilerinin de farkında olmalısınız.
En yaygın tedavi biçimleri arasında kemoterapi cerrahiye alternatif olarak kullanılabilir. Radyasyon tedavisi başka bir tedavi seçeneğidir. Radyo dalgalarını veya elektrik akımlarını kullanarak karaciğere zarar vermeden tümör hücrelerini öldürebilir. Radyoembolizasyon ise tümöre kan akışını durdurmak için maddeler kullanır. Riskli olmasına rağmen, karaciğer nakil ihtiyacı ilerlemiş kanserli ve şiddetli sirozlu hastalara yardımcı olabilir. Bu prosedürler genellikle ayakta tedavi prosedürleri olarak gerçekleştirilir ve sınırlı seçeneklere veya sınırlı kaynaklara sahip hastalar için en iyi seçenek olarak kabul edilir.
Karaciğer Sirozu Belirtileri
Hepatosellüler karsinom olarak da bilinen karaciğer sirozu, karaciğer kanserine ilerleyebilir. Hastalık, karaciğer fonksiyonunun bozulması ile kendini gösterir ve başka sorunlara da neden olabilir. Karaciğer sirozu belirtileri arasında en göze çarpan belirtiler şöyledir: Karaciğer hasarının ilk belirtileri karın veya bacaklarda sıvı toplanması olabilir. Bu sıvı bakteriyel peritonitin sonucu olabilir. Karaciğer hasarı ayrıca kan pıhtılaşma proteinlerinin üretimini yavaşlatarak, vücudun kolayca morarmasına neden olur. Fiziksel muayene siroz belirtilerini ortaya çıkarabilir. Şişmiş bir karın ve genişlemiş dalak iki yaygın belirtidir. Bazı insanlar ayrıca sarılık geçirirler ve dışkıları siyahtır. Diğer semptomlar arasında şiddetli karın ağrısı, yorgunluk ve hepatik ensefalopati vardır. Kronik alkol kullanımı, karaciğer sirozu gelişimi için risk faktörlerinden biridir.
Kaynak ; https://www.newstrendline.com/karaciger-kanseri-ve-karaciger-sirozu-nedir/
0 notes
Text
Kanser Haftası’nda Novartis Onkoloji "Kansere Karşı 1 Şey Söyle" diyor
Kanser Haftası’nda Novartis Onkoloji “Kansere Karşı 1 Şey Söyle” diyor
Toplumun her kesiminde kansere yönelik farkındalığı artırmak ve erken teşhisin önemine vurgu yapmak üzere 1-7 Nisan tarihleri arası Kanser Haftası olarak kutlanıyor. Türkiye’de onkoloji ve hematoloji alanındaki 20 ürünü ve 100’e yakın çalışanıyla hastaların yaşamlarını iyileştirmek için çalışan Novartis Onkoloji Türkiye, 1-7 Nisan Kanser Haftası kapsamında MetAmazon (Metastatik Meme Kanseri…

View On WordPress
0 notes
Text
Kanser Haftası’nda Novartis Onkoloji "Kansere Karşı 1 Şey Söyle" diyor
Kanser Haftası’nda Novartis Onkoloji “Kansere Karşı 1 Şey Söyle” diyor
Toplumun her kesiminde kansere yönelik farkındalığı artırmak ve erken teşhisin önemine vurgu yapmak üzere 1-7 Nisan tarihleri arası Kanser Haftası olarak kutlanıyor. Türkiye’de onkoloji ve hematoloji alanındaki 20 ürünü ve 100’e yakın çalışanıyla hastaların yaşamlarını iyileştirmek için çalışan Novartis Onkoloji Türkiye, 1-7 Nisan Kanser Haftası kapsamında MetAmazon (Metastatik Meme Kanseri…

View On WordPress
0 notes
Text
Metastas 2
6 sonuç bulundu.
Dosya Boyutu
Önizleme Bağlantıları
İndirme Bağlantıları
Metastatik Meme Kanseri – Tmhdf.org.tr2.hat tedavide fulvestrant 250 mg ve eksemestan etkinliği benzerdir, letrozol ve anastrazolün yanıt oranları arasında fark yoktur.19 Fulvestrant 500 mg, fulvestrant 250 mg göre sağkalım avantajı sağlamaktadır, bu nedenle 500 mg doz standart olarak kabul edilmelidir.20 ET kombinasyon…
View On WordPress
0 notes
Text
Metastatik meme kanserinde yeni tedavi yöntemleri
Metastatik meme kanserinde yeni tedavi yöntemleri
Sıçramalı (metastatik) göğüs kanseri tedavisinde yeni tedavi yaklaşımları hem hastaların sağ kalımlarını artırıyor hem de kemoterapi muhtaçlığını azaltıyor. Bilhassa hormon reseptör seviyesi olumlu olan sıçramalı göğüs kanserlerinde artık yeni maksatlı tedavilerle kemoterapiye gereksinim kalmadan, hastalık kronik hale getirilebilmektedir.
Türkiye’de ve dünyada bayanlarda en sık görülen ve hayat…

View On WordPress
0 notes
Text
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Sıçramalı (metastatik) meme kanseri tedavisinde yeni tedavi yaklaşımlarının hem hastaların sağ kalımlarını artırdığını, hem de kemoterapi ihtiyacını azalttığını söyleyen Tıbbi Onkoloji Uzmanı Prof. Dr. Bala Başak Öven, “Özellikle hormon reseptör düzeyi pozitif olan sıçramalı meme kanserlerinde artık yeni hedefli tedavilerle kemoterapiye ihtiyaç kalmadan, hastalık kronik hale getirilebilmektedir”…

View On WordPress
0 notes
Text
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Sıçramalı (metastatik) meme kanseri tedavisinde yeni tedavi yaklaşımlarının hem hastaların sağ kalımlarını artırdığını, hem de kemoterapi ihtiyacını azalttığını söyleyen Tıbbi Onkoloji Uzmanı Prof. Dr. Bala Başak Öven, “Özellikle hormon reseptör düzeyi pozitif olan sıçramalı meme kanserlerinde artık yeni hedefli tedavilerle kemoterapiye ihtiyaç kalmadan, hastalık kronik hale getirilebilmektedir”…

View On WordPress
0 notes
Text
Dokuz kez kanseri atlattı
Dokuz kez kanseri atlattı
44 yaşındaki Canan Perdahlı, bugüne kadar dokuz kanserle mücadele etti.
İlk kez 2010’da metastatik meme kanseri teşhisi konulan, ardından hastalığı diğer organlara da yayılan Canan Perdahlı (44), akciğer, kemik, rahim ve yumurtalık kanserleriyle mücadelesini anlattı.
Lisans eğitiminin ardından gittiği Yeni Zelanda’da otel yöneticiliği yaparken 2010’da metastatik meme kanseri tanısı aldığını…

View On WordPress
0 notes
Photo





Monoklonal antikorların öldürücü etkilerini 4 ana başlık altında ele alabiliriz:
–Monoklonal antikor antijene bağlandığında kompleman komponentlerini aktive eder.Bu da kanser hücrelerinin opsonizasyonuna neden olur.Kompleman reseptörlerini açığa çıkaran
fagositik hücreler tümör hücrelerini direkt lizise uğratır.
–Antikor bağımlı selüler sitotoksisite veya sitokinlerin salınımı
–Monoklonal antikorlar inhibitör Fc reseptörlerine bağlanırlar hedef hücre aktivasyonunu baskılarlar
–Monoklonal antikorlar direkt olarak büyüme faktörü reseptörlerine bağlanırlar ve bu şekilde kanser hücrelerinin ölümüne neden olurlar.
Monoklonal antikorların klinik kullanımı
I.Rituximab (MabThera):
Monoklonal antikorların klinik kullanımı
I.Rituximab (MabThera):
Rituximab CD20 proteinine karşı oluşturulmuş şimerik bir monoklonal antikordur. CD20 proteini B lenfositlerin yüzeyinde bulunan bir moleküldür. CD20 preB lenfositten B lenfosite kadarki hücrelerde bulunurken B lenfositlerden oluşan plazma hücrelerinin yüzeyinde bulunmaz. CD20 salınmaz, değiştirilmez ve hücre içine alınmaz. CD20’in kesin fonksiyonu bilinmemekle birlikte hücre içine kalsiyum salınımından sorumlu olduğu ve kalsiyum konsantrasyonunun devamlılığından sorumlu olduğu düşünülmektedir. Bu şekilde de B lenfositlerin aktivasyonunda rol oynadığı düşünülmektedir. CD20 molekülü B lenfositlerden kaynaklanan Kronik lenfoit lösemi ve lenfomalarda kanser hücreleri tarafından açığa çıkarılır. Rituximab kanser hücrelerinin yüzeyini antikorlarla kaplar. Bu şekilde antikorla kaplı hücreler NK hücrelerini aktifler. NK hücreleri antikor bağımlı yıkıma uğratırlar. Bu yıkım antikor bağımlı selüler sitotoksiteye bağlı olarak gelişir. Ayrıca rituximab kanser hücrelerinde bir takım değişikliklere neden olarak programlı hücre ölümüne neden olurlar ki bu apoptozis olarak da adlandırılır. Ayrıca rituximab kanser hücrelerinin kemoterapiye duyarlılığını da arttırır.
Rituximab B hücreli lenfomalarda CHOP tedavisine ilaveten verilebildiği gibi bazı otoimmun hastalıklarda da (RA, SLE, sjögren, otoimmun hemolitik anemi ve İTP) endikasyon almıştır. Son yıllarda renal transplant rejeksiyonlarında da çalışmalar sürmektedir.
Rituximab’ın yan etkileri:
– Ağır infüzyon reaksiyonu
– Kardiak arrest
– Tümör lizis sendromu
– İnfeksiyonlar: Hepatit B reaktivasyonu, diğer viral aktivasyonlar, Prograsif multıfokal lokoensefalopati
– Pulmoner toksisite
– SLE’li hastalarda ölüme neden olduğu bildirilmiştir
– Latent JC virüsü serebral aktivasyonu
Ayrıca yeni CD20 monoklonal antikorları da mevcuttur. Bunlardan ocrelizumab %90 humanize, ofatuzumab ise tümüyle humanize CD20 monoklonal antikorudur.
II.Alemtuzumab (Campath – 1H):
CD52 matur lenfositlerin yüzeyinde bulunan proteindir. Kök hücre yüzüeyinde bulunmamaktadır. Alemtuzumab anti-CD 52 etkinlikte bir monoklonal antikor olup nüks etmiş KLL hastasını içeren bir çalışmada % 33 oranında etkinlik göstermiş ve bu indikasyon ile klinik kullanıma girmiştir. Ayrıca T hücreli lenfoma için de endikasyon almıştır. Bunların yanı sıra KİT ve böbrek transplantasyonlarında da protokollere dahil edilebilmektedir. Alemtuzumab maliğnensiler dışında otoimmun hastalıklardan multıpl sklerozda da kullanılabildiği bildirilmektedir.Hipotansiyon, ateş, bronkospazm, döküntüler, ARDS, kardiak arrest ve aritmilere neden olabilmektedir. Kardiak etkileri ölümcül olabildiği bildirilmektedir.
III.Trastuzumab (Herceptin):
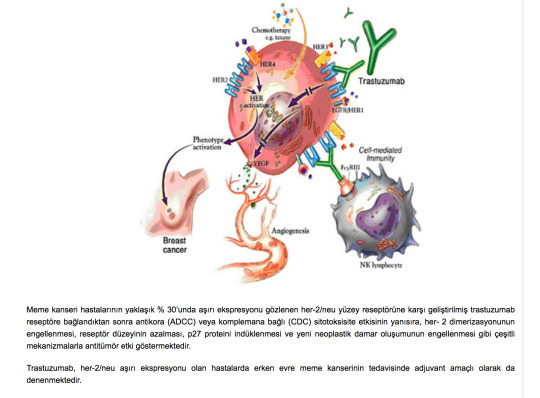
Trastuzumab, humanize monoklonal antikor olup, HER2/neu (erbB2) reseptörü üzerinde aktive olmaktadır. Asıl kullanım alanı HER2/neu reseptörü pozitif olan meme kanserli olgulardır. HER2/neu reseptörü %20-30 oranında erken meme kanseri olgularında pozitif bulunmaktadır.
Trastuzumab’ın etkinliğinin ortaya çıkması ile ilgili çeşitli mekanizmalar öne sürülmektedir:
– HER2/neu reseptör blokajı
– Anjiogenezin inhibisyonu
– HER2 reseptör down regülasyonu
Meme kanseri hastalarının yaklaşık % 30’unda aşırı ekspresyonu gözlenen her-2/neu yüzey reseptörüne karşı geliştirilmiş trastuzumab reseptöre bağlandıktan sonra antikora (ADCC) veya komplemana bağlı (CDC) sitotoksisite etkisinin yanısıra, her- 2 dimerizasyonunun engellenmesi, reseptör düzeyinin azalması, p27 proteini indüklenmesi ve yeni neoplastik damar oluşumunun engellenmesi gibi çeşitli mekanizmalarla antitümör etki göstermektedir.
Trastuzumab, her-2/neu aşırı ekspresyonu olan hastalarda erken evre meme kanserinin tedavisinde adjuvant amaçlı olarak da denenmektedir.
Trastuzumab’ın yan etkileri arasında kardiak toksisite en önemlisidir. Özellikle antrasiklin kullananlarda bu toksisite oranı çok daha belirgindir. %2-7 oranında kardiak toksisite bildirilmiştir. Buna bağlı olarak trastuzumab tedavisi sırasında MUGA scan veya ekokardiografi ile takip önerilmektedir.
Trastuzumab’ın diğer ilaçlarla etkileşimi:
İlaç etkileşim
Sisplatin sinerjistik
Dosetaksel sinerjistik
Vinorelbin Sinerjistik
Etoposit Sinerjistik
Tiyotepa Sinerjistik
İonizan radyasyon Sinerjistik
Doksurobisin Aditif
Vinblastin Aditif
Paklitaksel Aditif
Metotreksat Aditif
5-Floro-urasil Antagonistik
Paklitaksel ile trastuzumab’ın etkileşimi ilgi çekicidir. HER2 geni paklitakselin apoptozis yapıcı etkisini p21 isimli proteini aktive ederek inhibe eder. Bu durumda trastuzumab verilen hastalarda HER2 geni down regülasyonla azalınca paklitaksele bağlı apoptozis gelişimi tekrar sağlanmaktadır.
Antrasiklinlerle yapılan kombinasyonlarında(Antrasiklin/siklofosfamid + trastuzumab) kardiotoksisite %16 iken paklitakselle yapılan kombinasyonlarında bu oran %2 bulunmuştur. Bu nedenle antrasiklin içermeyen kombinasyonların daha uygun olacağı önerilmektedir.
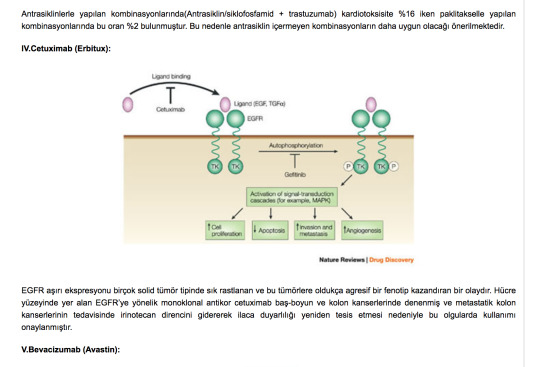
IV.Cetuximab (Erbitux):
EGFR aşırı ekspresyonu birçok solid tümör tipinde sık rastlanan ve bu tümörlere oldukça agresif bir fenotip kazandıran bir olaydır. Hücre yüzeyinde yer alan EGFR’ye yönelik monoklonal antikor cetuximab baş-boyun ve kolon kanserlerinde denenmiş ve metastatik kolon kanserlerinin tedavisinde irinotecan direncini gidererek ilaca duyarlılığı yeniden tesis etmesi nedeniyle bu olgularda kullanımı onaylanmıştır.
V.Bevacizumab (Avastin):
Bevacizumab angiogenez inhibitörlerinden olup, tümör hücrelerinde yeni damar oluşumunu engeller. Bu monoklonal antikor başlangıçta VEGF’ye bağlanır. VEGF tümör hücrelerinden yeni damar oluşumunu uyarmak için salınır. Becavizumab VEGF’ye bağlanınca kan damarlarındaki endotel yüzeyinde bulunan VEGF reseptörüne bağlanmasını engeller. VEGF reseptörlerinin aktivasyonu endotel hücrelerinin büyümesi ve tümör için besleyici yeni kan damalarının oluşumuna neden olur. Bu büyüme ve yeni damar oluşumunun engellenmesi, metaztazı engeller ve tümör hücrelerinin sitotoksik ilaçlara duyarlılığını arttırır.
Tümör neoangiogenezisinde çok önemli bir rol oynayan vasküler endotelyal büyüme faktörü (VEGF)’e karşı geliştirilen bir monoklonal antikor olan bevacizumab birçok tümör tipinde çalışmaları süren bir ajandır. Metastatik kolon kanseri olgularında yine kemoterapiye ek olarak kullanıldığında sağkalım avantajı sağladığının gösterilmesi bu amaçlı kullanımına olanak sağlamıştır. Radyoizotop ile konjuge edilmiş monoklonal antikorlar: Hodgkin-dışı lenfoma olgularında radyoaktif emisyon yayan radyoizotoplarla konjuge edilmiş anti-CD 20 monoklonal antikorlar ibritumomab (Zevalin) ve tositumomab (Bexxar) da özellikle rituximab direnci gösteren veya rituximab sonrası yineleyen düşük grade’li lenfomaların tedavisinde onaylanmıştır. ***. Kanser İmmün Terapi ve Monoklonal Antikorlar Çağrı ŞAKALAR1,3, Kenan İZGİ2,3, Halit CANATAN1,31Erciyes Üniversitesi, Tıp Fakültesi, Tıbbi Biyoloji Anabilim Dalı, Kayseri, TÜRKİYE2Erciyes Üniversitesi, Tıp Fakültesi, Tıbbi Biyokimya Anabilim Dalı, Kayseri, TÜRKİYE3Erciyes Üniversitesi, Genom ve Kök Hücre Araştırma Merkezi, Kayseri, TÜRKİYE Anahtar Kelimeler: Kanser, immün terapi, monoklonal antikorlar, etki mekanizmaları Özet Kanser immün terapi preklinik çalışmaların yoğun olduğu ve klinikte uygulamaların giderek arttığı kanser tedavisi için modern tıbbın adjuvan yöntemlerinden biridir. Kanser immün terapide aşı ve hücresel tedavi yöntemlerine göre daha fazla kullanım alanı bulunan yöntem monoklonal antikorların terapide kullanılmasıdır. Kanser hücrelerinde yüksek miktarda ve doku spesifik olarak üretilen reseptörler ile büyüme faktörlerini hedef alan monoklonal antikorlar klinik uygulamalara en fazla aktarılan ve onaylanan kanser immünoterapi uygulamasıdır. Klinikte kansere yönelik olarak halen onaylanmış ve kullanılmakta olan en az 12 adet monoklonal antikor bulunmaktadır. Bu monoklonal antikorlar meme, akciğer kanseri, kolorektal kanser, renal hücre kanseri, melanoma, çeşitli lenfoma ve lösemilerde tedavide kullanılmaktadır. Kanser immün terapide kullanılan monoklonal antikorlar, vasküler endotelyal büyüme faktörü (VEGF), epidermal büyüme faktörü reseptörü (EGFR), insan epidermal büyüme faktörü reseptörü 2 (HER2) gibi kanser progresyonunu destekleyen büyüme faktörlerini veya CD52 (Cluster of Differentiation 52) ve CD20 (Cluster of Differentiation Antigen 20) gibi kanser hücrelerinde spesifik olarak üretilen farklılaşma antijenlerini hedef alır. Monoklonal antikor üretim metodolojisi farelerin spesifik antijenlerle aşılanmasına ve B lenfositlerle myeloma kanser hücrelerinin hibridoma oluşturmasına dayanmaktadır. Bu teknikle tıpta devrim olarak nitelendirilebilecek şekilde yeni bir ilaç sınıfı doğmuş ve monoklonal antikorlar, kanser dahil çeşitli hastalıkların tedavisinde kullanılır olmuştur. Monoklonal antikorların kanser immünterapide etkinliği üç ana mekanizmaya dayanır. Bu mekanizmalar, 1) kanser hücrelerinin bölünme ve anjiyojenezde kullandıkları sinyal yolaklarını harekete geçiren faktörlerin ve reseptörlerin antikor bağlanmasıyla inhibe edilmesini, 2) antikora bağlı hücresel sitotoksisiteyi (ADCC) ve 3) komplement aktivasyonu ile komplemente bağlı sitotoksisiteyi (CDC) içerirler. Sonuç olarak yapılan preklinik çalışmalarla kanser oluşumu ve progresyonunda rol alan yeni hedef proteinler tespit edilmekte ve bunlara karşı etkin olabilecek monoklonal antikor üretim çalışmaları ve klinik faz çalışmaları devam etmektedir.Başa Dön Özet Giriş Kaynaklar GirişKanser İmmün Terapi Kanser immün terapi, kanser tedavisinde immün sistemin uygun metodlarla aktive edilip kullanılmasıdır. Amaç immün sisteme ait hücrelerin kanser hücrelerini hedef alarak yok etmesini sağlamaktır. Bu amaç temel olarak üç yöntemle sağlanabilir. a) Birinci yöntem kanserde üretilen proteinler kullanılarak hastaların aşılanmasına dayanır. b) İkinci yöntem terapi amaçlı spesifik antikorların hastaya verilmesi esasına dayanır. c) Üçüncü yöntem ise hastaya sitotoksik T lenfosit ya da dendritik hücreler gibi immün sistem hücrelerinin transfer edilmesi ile gerçekleştirilir. Kanser Aşıları
Birinci yöntem olan aşılama yöntemi bir çok farklı kanser türü için denenmiştir. Özellikle kanserde üretimi artan büyüme faktörlerini ya da reseptörleri hedef alan peptid, protein ya da DNA aşıları farklı adjuvantlarla beraber denenmiştir. Farklı antijen grupları üzerinde çalışılmış olup bunlardan birisi dokulara özel farklılaşma antijenlerini içerir. Bu grup içinde, melanoma için TRP2 adlı protein hedef alınmıştır. TRP2 melanoma tümör hücrelerinde spesifik olarak bulunan dokuya özel bir farklılaşma antijenidir1. Üzerinde çok çalışılan diğer bir antijen grubu tümörde üretimi anormal seviyede artmış ve tümor büyümesini destekleyen faktörleri kapsamaktadır. Meme kanseri için kötü prognozla ilişkilendirilen İnsan epidermal büyüme faktörü reseptörü 2 (HER2) bu antijenlerden biridir2. Kolon kanserini hedef almak için benzer şekilde epidermal büyüme faktörü reseptörüne (EGFR) odaklanan çalışmalar yapılmaktadır3. Aşı amaçlı hedef alınan üçüncü grup antijenler germ hücreleri ve kanser hücrelerinde üretilip normal dokularda olmayan kanser-testis antijenlerini kapsamaktadır. Ayrıca, çeşitli kanser türleri için NY-ESO- 1 adlı kanser-testis antijeni aşı çalışmalarında hedef alınmıştır4. Preklinik fare modellerinde başarılı sonuçlar elde edilmiş olan aşılama yöntemleri klinik denemelerde test edilmektedir ama henüz klinikte uygulanmakta olan otoimmün bir kanser aşısı bulunmamaktadır5. Kanser aşı çalışmalarıyla elde edilen önemli faydalardan birisi bu çalışmaların kanser tedavisinde kullanılan monoklonal antikorlarla ilgili çalışmaların temelini oluşturmuş olmalarıdır. Terapi Amaçlı Hücre Transferi
Kanserli hastalara aşı etkisi oluşturmak amacıyla T lenfosit ya da dendritik hücre aktarımı preklinik çalışmalarda yaygın olmasına rağmen, yakın geçmişte ilk defa klinik onay almayı başarmıştır. Klinik onay almış yaklaşımda profesyonel antijen sunan hücreler olan dendritik hücreler kullanılmıştır. Hastadan elde edilen dendritik hücreler hedef alınan antijenle beraber hücre kültür ortamında inkübe edilmektedir. Bu hücre kültür ortamı dendritik hücrelerin aktive edilmesini, antijeni alarak sunuma hazır hale getirmesini ve T lenfositleri uyarmaya uygun olgunlaşmayı gerçekleştirmesini sağlayacak şekilde tasarlanmıştır. Tasarlanan dendritik hücre aşısı prostat kanserlerinin %95'inde üretilen prostatik asit fosfataz (PAP) adlı antijen kullanılarak hazırlanmaktadır. Prostat kanserinde üretilen PAP adlı farklılaşma antijenini hedef almaya yönelik dendritik hücrelerin kültür ortamında uyarılarak hastaya verilmesini içeren Sipuleucel-T adlı hücre aşısı ileri evre metastatik prostat kanserli hastalarda hayatta kalma süresini dramatik olmasa da anlamlı oranda artırmıştır ve bu sure ortalama 4.1 aydır6. Tedaviye yanıt vermesi çok zor olan ileri evre metastatik prostat kanserli hastalarda hücre aşısı kullanılarak elde edilen sonuç bu alanda ilerisi için umut vadetmektedir. Monoklonal Antikorlar
Kanser immün terapi yöntemlerinden klinik uygulamalara en fazla aktarılan ve onaylananı terapiye yönelik monoklonal antikorlardır7. Günümüzde ilaç olarak üretilen başlıca antikorlar Trastuzumab, Cetuximab, Bevacizumab, Alemtuzumab, Rituximab gibi monoklonal antikorlardır. Hedef aldıkları başlıca kanserler meme kanseri, kolon kanseri ve çeşitli kan kanserleridir. Bunlar vasküler endotelyal büyüme faktörü (VEGF), EGFR, HER2 gibi kanseri destekleyen büyüme faktörlerini veya CD52 ve CD20 gibi kanser hücrelerinde spesifik olarak üretilen antijenleri hedef alır. Kullanımı çok yeni olan ve cytotoxic T lymphocyte-associated antigen 4, sitotoksik T lenfosit antijen -4 (CTLA-4) adlı antijeni bloke ederek kanserin immün sistemi inhibe etmesini engelleyen Ipilimumab monoklonal antikoru kullanılarak ileri safha melanom hastalarında başarı elde edilmiştir7-11. Klinikte kanser tedavisinde kullanılan başlıca monoklonal antikorlar ve hedef aldıkları bazı antijenlerle ilgili bilgiler aşağıda verilmiştir. Cetuximab ve Panitumumab
Epidermal büyüme faktörü reseptörü (EGFR) meme, over, kolorektal ve baş ve boyun kanseri gibi birçok kanser türünde overeksprese edilen bir tirozin kinaz reseptörüdür. Kanser hücre proliferasyonu, tümör büyümesi, anjiyojenez ve metaztazda rol alır12. Cetuximab EGFR'yi hedef alan ve kanser immün terapi amaçlı klinik olarak kullanıma onay almış bir monoklonal antikordur. Cetuximab kimerik bir antikordur, yani hem insana ait hem de fareye ait protein sekansları içerir. Bu antikor kolorektal kanser ve skuamöz hücre kanserlerinin tedavisinde kullanılmaktadır13. Panitumumab EGFR'yi hedef alan tamamen insan sekanları içeren bir monoklonal antikordur. Bu antikor aynı zamanda metastatik kolorektal kanser tedavisinde kullanılmaktadır14. Trastuzumab
HER2, EGFR ile aynı aileden olan bir tirozin kinaz reseptörü ve büyüme faktörüdür. HER-2 bir büyüme faktörü olarak meme kanserlerinin %25-30'unda anormal derece yüksek oranda eksprese edilmektedir. HER-2 ekspresyonu artan meme kanserinde bayanlarda hastalık daha agresif seyretmekte ve hayatta kalma süresinin daha kısa olduğu gözlenmektedir15-19. Trastuzumab HER-2'ye bağlanan humanize olarak üretilmiş (yani sekanslarının çoğu insana ait olan) IgG1 izotipinde bir monoklonal antikordur. Bu antikor HER-2'ye bağlanarak HER-2'nin kanser hücrelerinde aktive ettiği sinyal yolaklarını inhibe etmektedir. HER-2'ye karşı üretilen monoklonal bir antikor olan trastumuzab'ın ek tedavi olarak kullanıldığı meme kanseri hastalarında hayatta kalma süresinin anlamlı ölçüde uzadığı (25.1 aya karşılık 20.3 ay P=0.046) saptanmış ve ölüm riskinin %20 azaldığı tespit edilmiştir20. Rituximab ve Benzerleri
CD20 normal ve kötü huylu (malin) B hücrelerinde bulunan fakat prekursör B hücrelerinde bulunmayan bir farklılaşma antijenidir21. Rituximab CD20'yi hedef alan IgG1 izotipinde kimerik bir monoklonal antikordur. Bu antikorun B hücre non-Hodgkin lenfomaların tedavisinde etkinliği gösterilmiş ve klinik onayı alınmıştır. 1997'de onaylanan Rituximab kanser terapisi için klinik onay alan ilk monoklonal antikordur22-23. Sonrasında CD20'yi hedef alan Ibritumomab, Tositumomab, Ofatumumab gibi başka monoklonal antikorlar da klinik onay almıştır24. Alemtuzumab
CD52 tüm lenfositlerde bulunan bir farklılaşma antijendir ve bazı lenfomalarla ilişkilendirilmiştir. Bu nedenle bu antijenin hedef alınmasının belirli kanserlere karşı etkin olduğu görülmüştür25-27. Alemtuzumab CD52'yi hedef alan IgG1 izotipinde humanize bir monoklonal antikordur ve bu antikor için B hücre lösemisine yönelik kullanım için 2001'de klinik onay alınmıştır28. Ipilimumab
CTLA-4 (cytotoxic T lymphocyte-associated antigen 4, sitotoksik T lenfosit antijen -4) yardımcı T hücrelerinin mebranında eksprese edilir ve T hücrelerine inhibe edici sinyallerin gönderilmesinde rol alır29. Bu antijenin aktivitesini engellemek için Ipilimumab isimli bir monoklonal antikor dizayn edilmiştir. Böylece kanser tarafından immün sistemin inhibe edilmesinin ve baskılanmasının engellenmesi planlanmıştır30. İleri evre melanoma hastalarında ipilimumab tedavisi normal tedaviye oranla daha iyi hayatta kalma oranları sağlamıştır. 2011 yılında Ipilimumab'ın melanoma tedavisinde kullanımı için klinik onay alınmıştır8. Bevacizumab
Tümör gelişiminde en önemli aşamalardan birisi anjiyojenez adı verilen yeni damarların oluşumudur. Yeni damar oluşumunda en önemli faktörlerden birisi VEGF'tir. Metastatik kanserli hastaların çoğunluğunda serumda VEGF seviyesinin arttığı görülmüştür31. Bevacizumab VEGF'e bağlanan IgG1 izotipinde humanize bir monoklonal antikordur. Bu antikor VEGF'e bağlanarak anjiyojenez'i inhibe eder32. Bevacimuzab metastatik kolorektal kanserli hastalarda kemoterapiyle beraber kombine edilerek uygulandığında hayatta kalma oranını anlamlı ölçüde artırmıştır9. Bevacimuzab metastatik kolorektal kanserde ve küçük hücreli olmayan akciğer kanserinde kinik kullanım için onaylıdır. Kanser tedavisinde kullanılan daha fazla sayıda monoklonal antikorlar bulunmaktadır. Bu makalede kullanımı yaygın olan belirli monoklonal antikorlara değinilmiştir. Ayrıca yeni antijenleri hedef alan veya var olan antijenleri hedef alan yeni monoklonal antikorların denendiği çok sayıda klinik deneme devam etmektedir. Ayrıca şu da not edilmelidir ki, monoklonal antikorlar yorgunluk, ateş, baş ve kas ağrıları, nefes alma zorluğu ve kanamaların artması gibi çeşitli yan etkiler oluşturmaktadır24. Tablo 1'de kanser tedavisinde kullanılan başlıca monoklonal antikorlar, hedef aldıkları antijenler ve uygulandıkları kanser türleri özetlenmiştir.
Büyütmek İçin TıklayınTablo 1: Kanser tedavisinde kullanılan başlıca monoklonal antikorlar7,24,28,35,36 Monoklonal Antikorlar ve Kansere karşı Etki Mekanizmaları
Monoklonal antikorlar ilk olarak Köhler and Milstein tarafından 1975 yılında antijenle immünize edilmiş farelerin B hücreleri ve myelom kanser hücrelerinin oluşturdukları hibridomalardan elde edilmiştir33. Bu metodolojide aşılanan farelerden elde edilen B hücrelerinin herbiri tek bir çeşit antikor üretmektedir. Ancak B lenfositlerin hücre kültür ortamında yaşam süreleri çok kısıtlı olduğundan, myelom kanser hücreleriyle hibrid oluşturmaları sağlanır. Böylece yeni hücreler B lenfositler gibi spesifik antikorlar üretebilmekte ve kanser hücreleri gibi hücre kültüründe sınırsız bölünebilme potansiyeline sahip olmaktadır. En son aşamada tek bir klonun büyümesinden elde edilen hibridomalardan en uygun şekilde antikor üretenleri seçilerek monoklonal antikor üreten hibridoma klonları elde edilmiş olur. Monoklonal antikor üretimi metodolojisi Şekil 1'de özetlenmiştir.
Büyütmek İçin TıklayınŞekil 1: Monoklonal Antikorların Elde Edilme Metodolojisi Fareler tümörde spesifik olarak bulunan ve/veya hedef alınmak istenen antijenle immunize edilir. Serumda en iyi antikor cevabı veren fareler seçilerek, çok sayıda B hücresi içeren dalak hücreleri alınır. Bu hücreler ile fare myeloma hücrelerinin birleşerek hibridoma oluşturmaları sağlanır. Elde edilen hibridomalar çok sayıda kuyucukta besleyici hücrelerle beraber seçici medyumda kültür edilir ve belirli süreler içinde herbir kuyucuktaki hücre kültür medyumunda hedef antijene bağlanan antikor üretimi ELISA (Enzyme- Linked ImmunoSorbent Assay, Enzim - bağlantılı Immunosorbent Assay) ile test edilir. İstenen antikoru üreten kuyucuklardaki hibridomalar alt klonlamayla tek klonları elde etmek için tek düşürme işlemiyle tekrar kültür edilirler, hibridoma klonları elde edilir. Sonraki aşamada üretilen monoklonal antikor, protein saflaştırma teknikleriyle izole edilir. Şekil 1, 42 numaralı kaynaktan uyarlanmıştır. Monoklonal antikor üretim metodolojisinin dizaynı araştırmacılara sadece 1984 yılında nobel kazandırmakla kalmamış, aynı zamanda bu metodun kullanılmasıyla elde edilen antikorların kliniğe uygulanması tedavide yeni bir yol açmıştır. Şu anda klinik onkolojide Trastuzumab, Cetuximab, Bevacizumab, Alemtuzumab, Rituximab gibi antikorlar öncelikle monoklonal antikor üretim tekniğiyle elde edilmiş, kanser hücrelerine karşı etkinlikleri preklinik modellerde gösterilmiş ve sonrasında kimerize veya humanize edilerek hastalarda kullanıma geçmişlerdir. Monoklonal antikorlar kanser hücrelerine karşı temel olarak üç farklı mekanizmayla etkinlik gösterirler. Kanser hücrelerinin membran antijenlerine bağlanan antikorlar, 1- komplement aktivasyonu ile komplemente bağlı sitotoksisiteyi (CDC) ve 2- antikora bağlı hücresel sitotoksisiteyi (ADCC) tetiklerler. Antikora bağlı hücresel sitotoksisitede kanser hücrelerine bağlanmış antikorların sabit olan Fc fragmentleri başlıca naturel killer hücreler olmak üzere, makrofaj, monosit ve denritik hücreler gibi effektör hücreler tarafından FcGRIII ve FcGRIIa gibi reseptörlerle tanınırlar. Bu tanınma sonrası effektör hücreler kanser hücrelerini hedef alarak perforin ve serin proteazlar olan granzim (granzyme)'ler ile kanser hücrelerinin apoptoz ile ölmesine sebebiyet verirler. Üçüncü mekanizma ise kanser hücrelerinin bölünme ve anjiyojenezde kullandıkları sinyal yolaklarını harekete geçiren faktörlerin ve reseptörlerin antikor bağlanmasıyla inhibe edilmesidir. Buna örnek olarak bir çok sinyal yolağının aktivasyonunda rol alan epidermal büyüme faktörü reseptörünü hedef alan Cetuximab'ı ve anjiyogenezde rol alan vasküler endotelyal büyüme faktörünü hedef alan Bevacizumab'ı gösterebiliriz. Cetuximab adlı monoklonal antikor EGFR'ye bağlanır ve normalde EGFR'nin aktive ettiği MAP (Mitogen-Activated Protein) kinaz (MAPK), PI3 (phosphatidylinositol 3') kinaz (PI3K) ve Akt hücresel sinyal yolaklarını inhibe eder. Böylece, kanser hücrelerinin proliferasyonunu ve metastazını bir ölçüde engeller. Bevacimuzab ise vasküler endotelyal büyüme faktörünü hedef alarak tümörde yeni damar oluşumunu belirli oranda engeller34 -37. Monoklonal antikorların kanser hücrelerine karşı etkinkik mekanizmaları Şekil 2'de özetlenmiştir.
Büyütmek İçin TıklayınŞekil 2: Monoklonal antikorların tümör hücrelerine karşı etkinlik mekanizmaları Monoklonal antikorlar tümör hücrelerinin mebranındaki hedef antijenlere bağlanırlar. Bu bağlanma ile çeşitli mekanizmalarla tümör hücresinin ölümüne neden olurlar. Birinci mekanizmada bağlanan antikorun sabit Fc fragmenti effektör hücrelerde bulunan Fc gamma reseptörler tarafından tanınır. Bu effektör hücreler başlıca natürel killer hücreler ve monositlerdir. Effektör hücreler bağlanma sonrası tümör hücrelerinde antikora bağlı sitotoksisite (ADCC)'yi uyararak hücrede apoptozu uyarırlar. İkinci mekanizmada monoklonal antikorun bağlandığı membran antijeni önemli bir büyüme faktörü reseptörü veya büyüme faktörüdür. Bağlanma sonucu büyüme faktörü reseptörünün uyardığı tümör gelişiminde önemli olan sinyal yolakları engellenir. Bu şekilde tümör gelişimi inhibe edilir veya tümör hücresinde apoptoz uyarılır. Yukarıda bahsedilen monoklonal antikorlardan birisi olan ve CD20 antijenini hedef alan Rituximab tedavisine verilen cevaptaki genetik faktörler incelendiğinde, Fc Gamma reseptörlerinde ve komplement alt ünitelerindeki gen polimorfizmlerinin etkili olduğu görülmüştür38-39. Fc Gamma reseptörleri antikora bağlı hücresel sitotoksisitede görev almakta, komplement alt üniteleri ise komplemente bağlı sitotoksisitede görev almaktadır. Görüldüğü üzere, laboratuvarda hücre kültür deneylerine ek olarak, yapılan genetik korelasyon çalışmaları da, Rituximab'ın terapötik etkinliğinde ADCC ile CDC önemini desteklemektedir. Benzer şekilde EGFR'ye bağlanan Cetuximab'ın uygulanmasına kolorektal kanser hastalarının verdiği cevaba bakıldığında, iki farklı Fc Gamma reseptöründe bulunan polimorfizmlerin cevabı etkilediği görülmüştür. Cetuximab tedavisi alan metastatik kolorektal kanserli hastalarda, Fc Gamma Reseptör 2A ve 3A'daki polimorfizmlerle hastalık nüksetmeden hayatta kalma sürelerinin ilişkili olduğu bulunmuştur40. Meme kanseri tedavisinde kullanılan Trastumuzab'ın ADCC oluşturma etkinliğiyle Fc Gamma reseptör polimorfizmleri arasında da ilişki olduğu gösterilmiştir41. Sonuç olarak; Kanser oluşumu, progresyonu, metastazı, kanserin immün sistem elemanlarını tepkisiz hale getirme, tümör büyümesini artıracak faktörleri salgılamasını sağlama ve kemoterapiye direnç geliştirme mekanizmaları gibi birçok alanda preklinik araştırmalar devam etmekte, kanserin moleküler ve hücresel biyolojisi her geçen gün daha iyi anlaşılmaktadır. Bu araştırmalar sonucunda tespit edilen muhtemel hedef proteinlere yönelik üretilen monoklonal antikorlar preklinik çalışmalarda ve klinik faz çalışmalarında denenmektedir. Kemoterapiye destek gereken bazı durumlarda tedaviye monoklonal antikorların eklenmesi kanser tedavisi için umut vaat etmektedir.Başa Dön Özet Giriş Kaynaklar Kaynaklar1) Wang RF, Appella E, Kawakami Y, Kang X, Rosenberg SA. Identification of TRP-2 as a human tumor antigen recognized by cytotoxic T lymphocytes. J Exp Med 1996; 184: 2207–221. 2) Ladjemi MZ, Jacot W, Chardès T, Pèlegrin A, Navarro- Teulon I. Anti-HER2 vaccines: New prospects for breast cancer therapy. Cancer Immunol Immunother 2010; 59: 1295-312. 3) Cohen RB. Epidermal growth factor receptor as a therapeutic target in colorectal cancer. Clin Colorectal Cancer 2003; 2: 246–251. 4) Jager E, Chen YT, Drijfhout JW, et al. Simultaneous humoral and cellular immune response against cancertestis antigen NY-ESO-1: definition of human histocompatibility leukocyte antigen (HLA)-A2-binding peptide epitopes. J Exp Med 1998; 187: 265–270. 5) Srinivasan R, Wolchok JD. Tumor antigens for cancer immunotherapy: Therapeutic potential of xenogeneic DNA vaccines. J Transl Med 2004; 2: 12. 6) Kantoff PW, Higano CS, Shore ND, et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 2010; 363: 411–422. 7) Waldmann TA. Immunotherapy: past, present and future. Nature Medicine 2003; 9: 269–277. 8) Hodi FS, O'Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363: 711–723. 9) Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med 2004; 350: 2335–2342. 10) Keating MJ, Cazin B, Coutre S, et al. Campath-1H treatment of T-cell prolymphocytic leukemia in patients for whom at least one prior chemotherapy regimen has failed. J Clin Oncol 2002; 20: 205–213. 11) Reff ME, Carner K, Chambers KS, et al. Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20. Blood 1994; 83: 435–445. 12) Hamid O. Emerging treatments in oncology: focus on tyrosine kinase (erbB) receptor inhibitors. J Am Pharm Assoc 2004; 44: 52-8. 13) Aifa S, Rebai A. ErbB antagonists patenting: "playing chess with cancer". Recent Pat Biotechnol 2008; 2: 181-187. 14) Raffaele A, Michele C, Domenico C, et al. Panitumumab: a new frontier of target therapy for the treatment of metastatic colorectal cancer. Expert Review of Anticancer Therapy 2010; 10: 499-505. 15) Press MF, Pike MC, Chazin VR, et al. HER-2/neu expression in nodenegative breast cancer: direct tissue quantitation by computerized image analysis and association of overexpression with increased risk of recurrent disease. Cancer Res 1993; 53: 4960-4970. 16) Ravdin PM, Chamness GC. The c-erbB-2 proto-oncogene as a prognostic and predictive marker in breast cancer: a paradigm aborat development of other macromolecular markers-a review. Gene 1995; 159: 19-27. 17) Seshadri R, Firgaira FA, Horsfall DJ, et al. Clinical significance of HER-2/neu oncogene amplification in primary breast cancer. J Clin Oncol 1993; 11: 1936-1942. 18) Slamon DJ, Clark GM, Wong SG, et al. Human breast cancer: correlation of relapse and survival with amplification of the HER2-2/neu oncogene. Science 1987; 235: 177-182. 19) Slamon DJ, Godolphin W, Jones LA, et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science 1989; 244: 707-712. 20) Slamon DJ, Leyland-Jones B, Shak S, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001; 344: 783-792. 21) Chamuleau ME, van de Loosdrecht AA, Huijgens PC. Monoclonal antibody therapy in haematological malignancies. Curr Clin Pharmacol 2010; 5: 148-159. 22) Maloney DG, Grillo-López AJ, White CA et al. IDEC-C2B8 (Rituximab) anti-CD20 monoclonal antibody therapy in patients withrelapsed low-grade non-Hodgkin's lymphoma. Blood 1997; 90: 2188-2195. 23) Wood AM. Rituximab: an innovative therapy for non- Hodgkin's lymphoma. Am J Health Syst Pharm 2001; 58: 215-229 24) Elloumi J, Jellali K, Jemel I, Aifa S. Monoclonal antibodies as cancer therapeutics. Recent Pat Biotechnol. 2012; 6: 45-56. 25) Buggins AG, Mufti GJ, Salisbury J et al. Peripheral blood but not tissue dendritic cells express CD52 and are depleted by treatment with alemtuzumab. Blood 2002; 100: 1715-1720. 26) Ratzinger G, Reagan JL, Heller G, Busam KJ, Young JW. Differential CD52 expression by distinct myeloid dendritic cell subsets: implications for alemtuzumab activity at the level of antigen presentation in allogeneic graft-host interactions in transplantation. Blood 2003; 101: 1422- 1429. 27) Piccaluga PP, Agostinelli C, Righi S, Zinzani PL, Pileri SA. Expression of CD52 in peripheral T-cell lymphoma. Haematologica 2007; 92: 566-567. 28) Riechmann L, Clark M, Waldmann H, Winter G. Reshaping human antibodies for therapy. Nature 1988; 332: 323-327. 29) Beck KE, Blansfield JA, Tran KQ et al. Enterocolitis in Patients With Cancer After Antibody Blockade of Cytotoxic TLymphocyte– Associated Antigen 4. Journal of Clinical Oncology 2006: 24; 283-289. 30) Mori T. Ipilimumab, a new molecular targeted therapy of malignant neoplastic disease. Gan To Kagaku Ryoho 2011; 38: 31-35. 31) Kraft A, Weindel K, Ochs A, et al. Vascular endothelial growthfactor in the sera and effusions of patients with malignant and nonmalignant disease. Cancer 1999; 85: 178-187. 32) Los M, Roodhart JM, Voest EE. Target practice: lessons from phase III trials with bevacizumab and vatalanib in the treatment of advanced colorectal cancer. The Oncologist 2007; 12: 443-450. 33) Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256: 495–497. 34) Ferris RL, Jaffee EM, Ferrone S. Tumor antigen-targeted, monoclonal antibody-based immunotherapy: clinical response, cellular immunity, and immunoescape. Journal of Clinical Oncology 2010; 28: 4390-4399. 35) Reslan L, Dalle S, Dumontet C. Understanding and circumventing resistance to anticancer monoclonal antibodies. Mabs 2009; 1: 222-229. 36) Yamada T. Therapeutic monoclonal antibodies. Keio J Med. 2011; 60: 37-46. 37) Yarden Y, Sliwkowski MX. Untangling the ErbB signaling network. Nat Rev Mol Cell Biol 2001; 2: 127-37. 38) Cartron G, Dacheux L, Salles G, et al. Therapeutic activity of humanized anti-CD20 monoclonal antibody and polymorphism in IgG Fc receptor FcgammaRIIIa gene. Blood 2002; 99: 754-758. 39) Racila E, Link BK, Weng WK, et al. A polymorphism in the complement component C1qA correlates with prolonged response following rituximab therapy of follicular lymphoma. Clin Cancer Res 2008; 14: 6697-6703. 40) Zhang W, Gordon M, Schultheis AM, et al. FCGR2A and FCGR3A polymorphisms associated with clinical outcome of epidermal growth factor receptor expressing metastatic colorectal cancer patients treated with single-agent cetuximab. J Clin Oncol 2007; 25: 3712-8. 41) Musolino A, Naldi N, Bortesi B, et al. Immunoglobulin G fragment C receptor polymorphisms and clinical efficacy of trastuzumab-based therapy in patients with HER-2/neupositive metastatic breast cancer. J Clin Oncol 2008; 26: 1789-1796. 42) Michnick SW, Sidhu SS. Submitting antibodies to binding arbitration. Nat Chem Biol 2008; 4: 326–329.Başa Dön Özet Giriş Kaynaklar
0 notes
Text
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Sıçramalı (metastatik) meme kanseri tedavisinde yeni tedavi yaklaşımlarının hem hastaların sağ kalımlarını artırdığını, hem de kemoterapi ihtiyacını azalttığını söyleyen Tıbbi Onkoloji Uzmanı Prof. Dr. Bala Başak Öven, “Özellikle hormon reseptör düzeyi pozitif olan sıçramalı meme kanserlerinde artık yeni hedefli tedavilerle kemoterapiye ihtiyaç kalmadan, hastalık kronik hale getirilebilmektedir”…

View On WordPress
0 notes
Text
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Sıçramalı (metastatik) meme kanseri tedavisinde yeni tedavi yaklaşımlarının hem hastaların sağ kalımlarını artırdığını, hem de kemoterapi ihtiyacını azalttığını söyleyen Tıbbi Onkoloji Uzmanı Prof. Dr. Bala Başak Öven, “Özellikle hormon reseptör düzeyi pozitif olan sıçramalı meme kanserlerinde artık yeni hedefli tedavilerle kemoterapiye ihtiyaç kalmadan, hastalık kronik hale getirilebilmektedir”…

View On WordPress
0 notes
Text
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Metastatik Meme Kanserinde Yeni Tedavi Yaklaşımları Umut Vaat Ediyor
Sıçramalı (metastatik) meme kanseri tedavisinde yeni tedavi yaklaşımlarının hem hastaların sağ kalımlarını artırdığını, hem de kemoterapi ihtiyacını azalttığını söyleyen Tıbbi Onkoloji Uzmanı Prof. Dr. Bala Başak Öven, “Özellikle hormon reseptör düzeyi pozitif olan sıçramalı meme kanserlerinde artık yeni hedefli tedavilerle kemoterapiye ihtiyaç kalmadan, hastalık kronik hale getirilebilmektedir”…

View On WordPress
0 notes